题目内容
6.下列说法正确的是( )| A. | 需要加热的化学反应都是吸热反应 | |
| B. | 水力发电是将化学能转化为电能的过程 | |
| C. | 食醋、纯碱、食盐分别属于酸、碱、盐 | |
| D. | 生铁、不锈钢、青铜都属于合金 |
分析 A.放热反应有时需要引发;
B.水力发电将水能转化为电能;
C.纯碱是Na2CO3,是阳离子是金属离子,阴离子是酸根离子的化合物;
D.合金是由两种或两种以上的金属与金属(或非金属)经一定方法熔合而成的具有金属特性的物质.结合各物质的成分判断.
解答 解:A.放热反应有时需要加热引发,如铝热反应,所以需要加热的化学反应不一定是吸热反应,故A错误;
B.水力发电是将水能主要是机械能转化为电能的过程,没有发生化学反应,不是将化学能转化为电能,故B错误;
C.纯碱是Na2CO3,是阳离子是金属离子,阴离子是酸根离子的化合物,是盐不是碱,故C错误;
D.生铁的主要成分是铁与碳,属于合金,不锈钢是在碳素钢中加入铬、锰、钨、镍、硅、钴等合金元素,属于合金,青铜主要含有铜、锡、铅等,属于合金,故D正确;
故选D.
点评 本题考查放热反应和能量的转化、酸碱盐的概念的辨析、合金等问题,难度较小,旨在考查学生对基础知识的识记,注意基础知识的积累掌握.

练习册系列答案
相关题目
12.黑火药爆炸时可发生如下反应:4S+16KNO3+16C→3K2SO4+4K2CO3+K2S+12CO2↑+8N2↑,下列有关说法正确的是( )
| A. | KNO3只发生氧化反应 | B. | 反应消耗12g C时电子转移5mol | ||
| C. | 还原产物只有K2S和 N2 | D. | 被氧化与被还原的S为1:3 |
17.工业上获得大量乙烯、丙烯、丁二烯的方法是( )
| A. | 卤代烃消除 | B. | 煤高温干馏 | C. | 炔烃加成 | D. | 石油裂解 |
14.如表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:
(1)③、④、⑦的原子半径由大到小的顺序为Na>Cl>F (用元素符号表示).
(2)⑥和⑦的最高价含氧酸的酸性强弱为HClO4>H2SO4 (用酸的化学式表示).
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe 2+氧化,写出该反应的离子方程式H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性.

①写出D溶液与G反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
②写出检验A溶液中溶质的阴离子的方法取少量A溶液滴加几滴(稀硝酸酸化)硝酸银溶液有白色沉淀生成.
③常温下,若电解1L0.1mol•L-1的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为0.01mol.
④写出过量的E与F溶液中溶质反应的离子方程式AlO2-+4H+=Al3++2H2O.
(5)由②、④、⑥元素组成的化合物W(在酸性溶液中发黄,W还原性较强),在溶液中易被⑦的单质氧化,该反应的离子方程式为S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+.
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(2)⑥和⑦的最高价含氧酸的酸性强弱为HClO4>H2SO4 (用酸的化学式表示).
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe 2+氧化,写出该反应的离子方程式H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性.

①写出D溶液与G反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
②写出检验A溶液中溶质的阴离子的方法取少量A溶液滴加几滴(稀硝酸酸化)硝酸银溶液有白色沉淀生成.
③常温下,若电解1L0.1mol•L-1的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为0.01mol.
④写出过量的E与F溶液中溶质反应的离子方程式AlO2-+4H+=Al3++2H2O.
(5)由②、④、⑥元素组成的化合物W(在酸性溶液中发黄,W还原性较强),在溶液中易被⑦的单质氧化,该反应的离子方程式为S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+.
1.某一不饱和酯类化合物(如图)在药物、涂料等领域应用广泛,下列有关说法不正确的是( )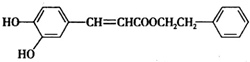
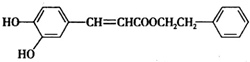
| A. | 能使KMnO4溶液褪色 | |
| B. | 1mol的该化合物和足量的钠反应生成1molH2 | |
| C. | 能与溴发生取代反应和加成反应 | |
| D. | 1mol该化合物最多与2molNaOH反应 |
11.在研究物质变化时,人们可以从不同的角度,不同的层面来认识物质变化时所引起的化学键及其能量变化,据此判断以下叙述中错误的是( )
| A. | 化学反应的实质是旧键的断裂和新化学键生成 | |
| B. | 所有化学变化一定遵循质量守恒和能量守恒 | |
| C. | 在化学反应中,破坏旧化学键吸收的能量大于形成新化学键释放的能量时,该反应是吸热反应 | |
| D. | 化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 |
18.在对电子运动状态的描述中,确定一个“轨道”的方面包括( )
①电子层 ②电子亚层 ③电子云的伸展方向 ④电子的自旋状态.
①电子层 ②电子亚层 ③电子云的伸展方向 ④电子的自旋状态.
| A. | ①②③④ | B. | ①②③ | C. | ①② | D. | ① |
15.如图可设计成多种用途的电化学装置.下列分析正确的是( )
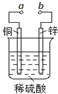

| A. | 当a和b用导线连接时,溶液中的SO42-向铜片附近移动 | |
| B. | 将a与电源正极相连可以保护锌片,这叫牺牲阳极的阴极保护法 | |
| C. | 当a和b用导线连接时,铜片上发生的反应为:2H++2e→H2↑ | |
| D. | a和b用导线连接后,电路中通过0.02mol电子时,产生0.02mol气体 |