题目内容
20.短周期主族元素A、B、C、D、E的原子序数依次增大,其中A与C同主族,A与其它元素不在同一周期,B与D同主族,常温下D的单质为淡黄色固体.下列推断正确的是( )| A. | 原子半径由小到大的顺序:r(C)<r(D)<r(E) | |
| B. | 元素D、E分别与A形成的化合物的热稳定性:E>D | |
| C. | 元素D的最高价氧化物对应水化物的酸性比E的强 | |
| D. | 元素B分别与A、C形成的化合物中化学键的类型不同 |
分析 短周期主族元素A、B、C、D、E的原子序数依次增大,常温下D的单质为淡黄色固体,则D为S元素;B与D同主族,则B为O元素;A与C同主族,A与其它元素不在同一周期,则A为H元素,结合原子序数可知C为Na,E的原子序数大于S,故E为Cl,结合元素周期律进行解答.
解答 解:短周期主族元素A、B、C、D、E的原子序数依次增大,常温下D的单质为淡黄色固体,则D为S元素;B与D同主族,则B为O元素;A与C同主族,A与其它元素不在同一周期,则A为H元素,结合原子序数可知C为Na,E的原子序数大于S,故E为Cl.
A.同周期自左而右原子半径增大,故原子半径Na>S>Cl,故A错误;
B.同周期自左而右非金属性增强,故非金属性Cl>S,非金属性越强氢化物越稳定,故氢化物稳定性HCl>H2S,故B正确;
C.同周期自左而右非金属性增强,故非金属性Cl>S,非金属性越强最高价氧化物对应水化物的酸性越强,故酸性:高氯酸>硫酸,故C错误;
D.元素O分别与H元素形成的化合物为H2O或H2O2,只含有共价键,而O元素与Na元素C形成的化合物为Na2O或Na2O2,前者含有离子键,后者含有离子键、共价键,含有化学键类型不相同,故D正确,
故选BD.
点评 本题考查结构性质位置关系应用,难度不大,推断元素好是解题关键,注意对基础知识的理解掌握.

练习册系列答案
相关题目
11.下列反应的离子方程式书写正确的是( )
| A. | 钠和水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| C. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
8.化学椭圆生活息息相关,下列有关说法正确的是( )
| A. | 明矾可用于自来水的杀菌消毒 | |
| B. | 钢铁在干燥的空气里不易被腐蚀,而在潮湿的空气里容易被腐蚀 | |
| C. | 生石灰能与水反应,可用来干燥氧气 | |
| D. | SiO2可用于制半导体材料,是利用了SiO2的导电性 |
15.短周期主族X、Y、Z、W、Q的原子序数依次增大,X+中只含有1个质子,Y原子的最外层电子数是内层电子数的2倍,Z 和 Q同主族且能形成两种常见化合物QZ2、QZ3,W是短周期中原子半径最大的元素.下列叙述正确的是( )
| A. | Y3X8分子中,极性键和非极性键的个数比为8:3 | |
| B. | Z和Q形成的两种化合物中只有一种属于酸性氧化物 | |
| C. | 25℃时,若WZX溶液中的C(OH-):C(H+)=1012,则该溶液的pH=13 | |
| D. | Q元素在自然界中不能以游离态存在 |
12.分子量为177的某无机物中含C、H、O、Br四种元素,实验还测知化合物中氢元素与碳元素的质量比为1:8,该有机物的分子式是( )
| A. | C2H6Br2O | B. | C6H9BrO | C. | C2H3Br2O | D. | C3H6BrO |
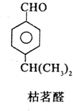 $→_{一定条件}^{试剂X}$A
$→_{一定条件}^{试剂X}$A B$→_{一定条件}^{2H_{2},Ni}$C$→_{△}^{Cu,O_{2}}$
B$→_{一定条件}^{2H_{2},Ni}$C$→_{△}^{Cu,O_{2}}$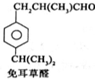
 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$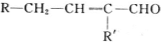
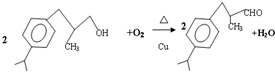 +H20.
+H20. 、
、 .
.