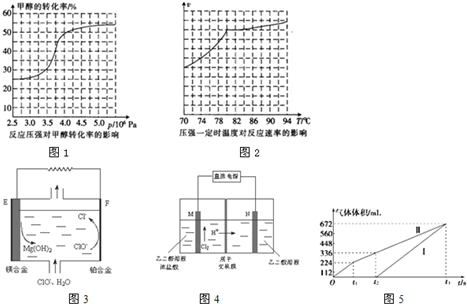
17.下列实验装置正确且能完成实验目的是( )
| A. | 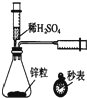 测定一定时间内生成H2的反应速率 | B. | 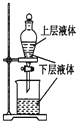 提取海带中的碘 | ||
| C. | 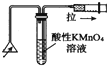 检验火柴燃烧产生的SO2 | D. | 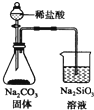 证明非金属性:Cl>C>Si |
16.已知酸性:H2SO4>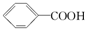 >H2CO3>
>H2CO3>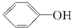 >HCO3-,综合考虑反应物的转化率和原料成本等因素,将
>HCO3-,综合考虑反应物的转化率和原料成本等因素,将 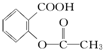 转变为
转变为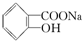 的最佳方法是( )
的最佳方法是( )
 >H2CO3>
>H2CO3> >HCO3-,综合考虑反应物的转化率和原料成本等因素,将
>HCO3-,综合考虑反应物的转化率和原料成本等因素,将  转变为
转变为 的最佳方法是( )
的最佳方法是( )| A. | 与足量的NaOH溶液共热后,再通入足量CO2 | |
| B. | 与足量的NaOH溶液共热后,再加入适量H2SO4 | |
| C. | 与稀H2SO4共热后,加入足量的NaOH溶液 | |
| D. | 与稀H2SO4共热后,加入足量的Na2CO3溶液 |
15.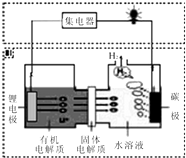 近几年科学家发明的一种新型可控电池--锂水电池,工作原理如图所示.下列有关说法不正确的是( )
近几年科学家发明的一种新型可控电池--锂水电池,工作原理如图所示.下列有关说法不正确的是( )
 近几年科学家发明的一种新型可控电池--锂水电池,工作原理如图所示.下列有关说法不正确的是( )
近几年科学家发明的一种新型可控电池--锂水电池,工作原理如图所示.下列有关说法不正确的是( )| A. | 碳极发生的反应是:2H2O+2e-=H2↑+2OH - | |
| B. | 有机电解质和水溶液不可以互换区域 | |
| C. | 标况下产生22.4L的氢气时,正极消耗锂的质量为14g | |
| D. | 该装置不仅可提供电能,还可得到清洁的氢气 |
14.向硫酸铜溶液中通入足量NH3后可得到深蓝色溶液[溶质为Cu(NH3)4SO4],再向所得溶液通入SO2至溶液呈微酸性发现有白色沉淀Q生成,反应方程式为:①2Cu(NH3)4SO4+3SO2+4H2O=2NH4CuSO3↓+3(NH4)2SO4.再将Q与足量的10mol/L硫酸混合微热,则会发生如下反应:②2NH4CuSO3+2H2SO4=Cu+(NH4)2SO4+2SO2+CuSO4+2H2O.对上述两个反应的有关分析中正确的是( )
| A. | ①是非氧化还原反应,而②是氧化还原反应 | |
| B. | 上述反应中SO2的作用只相当于催化剂 | |
| C. | 反应②中CuSO4是氧化产物 | |
| D. | 反应①中SO2发生还原反应 |
13.25℃时,浓度均为0.1mol/L的溶液,其pH如下表所示.有关说法正确的是( )
| 序号 | ① | ② | ③ | ④ |
| 溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
| pH | 7.0 | 7.0 | 8.1 | 8.4 |
| A. | 酸性强弱:H2CO3>HF | |
| B. | ①和②中溶质均未水解 | |
| C. | 离子的总浓度:①>③ | |
| D. | ④中:c(HCO3-)+2c(CO32-)+c(H2CO3)═0.1 mol/L |
11.Al(OH)3即能与酸起反应,又能与强碱溶液起反应生成盐和水,说明Al(OH)3属于( )
| A. | 两性氧化物 | B. | 两性氢氧化物 | C. | 盐 | D. | 有机物 |
10.下列能用H++OH-=H2O表示的是( )
| A. | 稀硫酸和氢氧化钡溶液反应 | B. | 稀硝酸与氢氧化钠溶液反应 | ||
| C. | 醋酸与氢氧化钾溶液反应 | D. | 盐酸与氢氧化铁反应 |
8.如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法错误的是( )
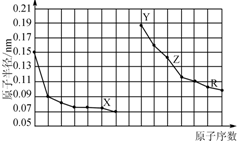
0 167331 167339 167345 167349 167355 167357 167361 167367 167369 167375 167381 167385 167387 167391 167397 167399 167405 167409 167411 167415 167417 167421 167423 167425 167426 167427 167429 167430 167431 167433 167435 167439 167441 167445 167447 167451 167457 167459 167465 167469 167471 167475 167481 167487 167489 167495 167499 167501 167507 167511 167517 167525 203614

| A. | X、R的最高化合价相同 | |
| B. | 简单离子的半径:X>Y>Z | |
| C. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |