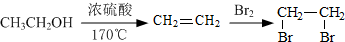题目内容
17.下列实验装置正确且能完成实验目的是( )| A. | 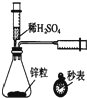 测定一定时间内生成H2的反应速率 | B. | 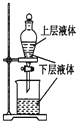 提取海带中的碘 | ||
| C. | 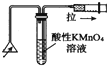 检验火柴燃烧产生的SO2 | D. | 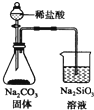 证明非金属性:Cl>C>Si |
分析 A.测定生成氢气的反应速率需要测定时间和收集气体体积;
B.海带中碘以离子的形式存在;
C.二氧化硫具有还原性,能使高锰酸钾溶液褪色;
D.生成的二氧化碳中含有HCl而干扰实验,元素的非金属性越强其最高价氧化物的水化物酸性越强.
解答 解:A.测定生成氢气的反应速率需要测定时间和收集气体体积,有测定体积的仪器和测定时间的仪器,所以可以实现实验目的,故A正确;
B.海带中碘以离子的形式存在,应先发生氧化还原反应后生成碘单质,再萃取、分液,故B错误;
C.二氧化硫具有还原性,能使高锰酸钾溶液褪色,图中试管中的导管长短应互换,故C错误;
D.盐酸具有挥发性,生成的二氧化碳中含有氯化氢,HCl也能和硅酸钠反应生成硅酸沉淀,所以干扰实验,且HCl不是氯元素的最高价氧化物是水化物,所以不能实现实验目的,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高考高频点,明确实验原理是解本题关键,涉及非金属性的比较、氧化还原、碘的提纯等,注意实验原理和实验细节的考查,题目难度中等.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
7.下列说法或表示方法正确的是( )
| A. | 2A(l)+B(l)=2C(l)△H1 2A (g)+B(g)=2C(l)△H2 则△H1>△H2 | |
| B. | 31g红磷变成31g白磷要吸收能量,说明红磷比白磷更稳定 | |
| C. | 测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸的起始温度、NaOH的起始温度和反应结束后稳定的温度 | |
| D. | 在101 kPa时,已知氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ/mol |
8.下列有关化学用语表述不正确的是( )
| A. | 氨气分子的电子式: | B. | CO2分子的结构式:O=C=O | ||
| C. | S2-的结构示意图: | D. | CH4的分子模型示意图为: |
5.设nA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1L 0.1mol/L的醋酸溶液含有0.1nA个H+ | |
| B. | 1molSiO2与足量的焦炭高温下完全反应生成硅,转移4nA个电子 | |
| C. | 标准状况下,11.2L H2O含有共价键的数目为nA | |
| D. | 常温常压下,14 g 由N2与C2H4组成的混合气体含有的原子数目为nA |
9.最新科技报道,美国夏威夷联合天文中心的科学家发现了新型氢粒子,这种氢粒子是由3个氢原子核(只含质子)和2个电子构成的.对于这种粒子,下列说法中正确的是( )
| A. | 是氢的一种新的同素异形体 | B. | 3g该新型氢粒子含电子2NA | ||
| C. | 是氢的一种新的同位素 | D. | 它的组成可用H3表示 |
6. 分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )
 分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )| A. | 该晶体是原子晶体 | |
| B. | M的离子位于上述立方体的面心,呈+2价 | |
| C. | M的离子位于上述立方体的体心,呈+1价,且M+空缺率(体心中没有M+的占总体心的百分比)为50% | |
| D. | 晶体的化学式可表示为MFe2(CN)3,且M为+1价 |
7.短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
| R | |||
| T | Q | W | |
| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 含T的盐中,T元素只能存在于阳离子中 |
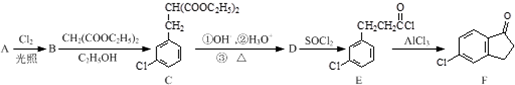
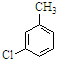 ,反应E→F的反应类型取代反应.
,反应E→F的反应类型取代反应.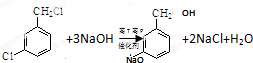 .
.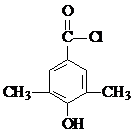 或
或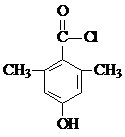 (任写一种).
(任写一种).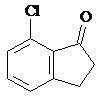
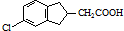 的合成路线流程图(注明反应条件).合成路线流程图示例如下:
的合成路线流程图(注明反应条件).合成路线流程图示例如下: