题目内容
11.Al(OH)3即能与酸起反应,又能与强碱溶液起反应生成盐和水,说明Al(OH)3属于( )| A. | 两性氧化物 | B. | 两性氢氧化物 | C. | 盐 | D. | 有机物 |
分析 既能与酸反应生成盐与水又能与碱反应生成盐与水的氢氧化物属于两性氢氧化物.
解答 解:A.氧化物含有2种元素,其中一种元素为氧元素,且必须负价,而氢氧化铝含有H元素,不属于氧化物,故A错误;
B.Al(OH)3即能与酸起反应生成氯化铝与水,又能与强碱溶液起反应生成盐和水,说明Al(OH)3属于两性氢氧化物,故B正确;
C.氢氧化铝属于碱,不属于盐,故C错误;
D.氢氧化铝不含碳元素,属于无机物,故D错误,
故选B.
点评 本题考查物质分类,比较基础,注意理解中学常见既与酸又能与碱反应的物质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下列化学用语正确的是( )
| A. | 醛基的电子式: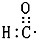 | B. | 丙烷分子的比例模型: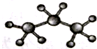 | ||
| C. | 三硝基甲苯的结构 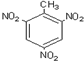 | D. | 2-乙基-1,3-丁二烯分子的键线式: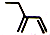 |
19.现有一瓶A和B的混合液,已知A和B的某些性质如下:
由此,分离A和B的最佳方法是( )
| 物质 | 分子式 | 熔点℃ | 沸点℃ | 密度g•cm-3 | 水溶性 |
| A | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
| B | C4H8O2 | -84 | 97 | 0.90 | 可溶 |
| A. | 萃取 | B. | 升华 | C. | 分馏 | D. | 分液 |
6.某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl.下列说法正确的是( )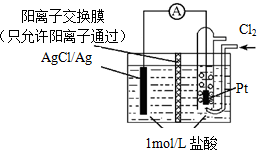

| A. | 正极反应为Ag-e-=Ag+ | |
| B. | 放电时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 当电路中转移0.1mol e-,通过交换膜的阳离子为0.2mol | |
| D. | 用KCl溶液代替盐酸,则电池总反应不改变 |
16.已知酸性:H2SO4>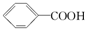 >H2CO3>
>H2CO3>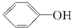 >HCO3-,综合考虑反应物的转化率和原料成本等因素,将
>HCO3-,综合考虑反应物的转化率和原料成本等因素,将 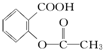 转变为
转变为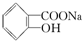 的最佳方法是( )
的最佳方法是( )
 >H2CO3>
>H2CO3> >HCO3-,综合考虑反应物的转化率和原料成本等因素,将
>HCO3-,综合考虑反应物的转化率和原料成本等因素,将  转变为
转变为 的最佳方法是( )
的最佳方法是( )| A. | 与足量的NaOH溶液共热后,再通入足量CO2 | |
| B. | 与足量的NaOH溶液共热后,再加入适量H2SO4 | |
| C. | 与稀H2SO4共热后,加入足量的NaOH溶液 | |
| D. | 与稀H2SO4共热后,加入足量的Na2CO3溶液 |
3.下列反应属于吸热反应的是( )
①二氧化碳与赤热的炭反应生成一氧化碳 ②葡萄糖在人体内氧化分解
③锌粒与稀H2SO4反应制取H2④Ba(OH)2•8H2O固体与NH4Cl固体反应
⑤植物通过光合作用将CO2转化为葡萄糖.
①二氧化碳与赤热的炭反应生成一氧化碳 ②葡萄糖在人体内氧化分解
③锌粒与稀H2SO4反应制取H2④Ba(OH)2•8H2O固体与NH4Cl固体反应
⑤植物通过光合作用将CO2转化为葡萄糖.
| A. | ②④ | B. | ①⑤ | C. | ①③④⑤ | D. | ①④⑤ |
20.部分弱酸的电离平衡常数如表,下列表述肯定正确的是( )
| 弱酸 | H2CO3 | H2SO3 | HClO |
| 电离平衡常数 (25℃) | K1=4.30×10-7 | K1=1.54×10-2 | K=2.95×10-8 |
| K2=5.61×10-11 | K2=1.02×10-7 |
| A. | 相同温度时三种溶液的pH关系:Na2CO3>NaClO>Na2SO3 | |
| B. | ClO-+H2O+CO2→HClO+HCO3- | |
| C. | 2ClO-+SO2+H2O→2HClO+SO32- | |
| D. | 等体积、等物质的量浓度的HClO和Na2CO3混合后溶液呈中性 |
1. 一定温度下:在2.0L密闭容器中,发生X(g)?Y(g)+Z(g)△H<0,容器内反应物X的物质的量随反应时间t的变化关系如图所示.以下分析正确的是( )
一定温度下:在2.0L密闭容器中,发生X(g)?Y(g)+Z(g)△H<0,容器内反应物X的物质的量随反应时间t的变化关系如图所示.以下分析正确的是( )
 一定温度下:在2.0L密闭容器中,发生X(g)?Y(g)+Z(g)△H<0,容器内反应物X的物质的量随反应时间t的变化关系如图所示.以下分析正确的是( )
一定温度下:在2.0L密闭容器中,发生X(g)?Y(g)+Z(g)△H<0,容器内反应物X的物质的量随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | 从反应开始到t1时的平均反应速率为v(X)=$\frac{0.2}{{t}_{1}}$ mol/(L•min) | |
| B. | 反应达到平衡时,Y和Z的物质的量共减少0.8mol | |
| C. | 欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 | |
| D. | 反应到t2时刻后,保持其他条件不变,缩小容器的体积,再次平衡后,X的物质的量小于0.9mol |

 .
.