14.臭氧是理想的烟气脱硝剂,其脱销反应为:2NO2(g)+O3(g)?N2O5(g)+O2(g),在T温度下,向2.0L恒容密闭容器中充入2.0molNO2和1.0molO3,经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
下列有关说法正确的是( )
| t/s | 0 | 3 | 6 | 12 | 24 |
| n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
| A. | 反应在0~3s的平均速率为v(NO2)=0.24mol•L-1•s-1 | |
| B. | 24s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44mol•L-1,则反应的△H<0 | |
| C. | 在T温度下,起始时向容器中充入1.0molNO2、0.5molO3和0.50molN2O5、0.50molO2,反应达到平衡时,压强为起始的0.88倍 | |
| D. | 在T温度下,起始时向容器中充入2.0molN2O5和2.0molO2,达到平衡时,N2O5的转化率大于20% |
13.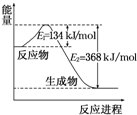 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
(1)如图是1mol NO2和1mol CO 反应生成 CO2和NO的过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)═NO(g)+CO2(g);△H=-234 kJ•mol-1.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)??2NH3(g);△H<0,其化学平衡常数K与T的关系如表所示:
请完成下列问题:
①试比较K1、K2的大小,K1>K2(填“>”、“=”或“<”).
②下列各项能作为判断该反应达到化学平衡状态依据的是c(填序号).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v正(N2)=3v逆(H2)
c.容器内压强保持不变
d.混合气体的密度保持不变
③400℃时,反应2NH3(g)??N2(g)+3H2(g)的化学平衡常数K为2.当测得NH3、N2、H2的物质的量分别为3mol、2mol、1mol时,则该反应的v正(N2)>v逆(N2)(填“>”、“=”或“<”).
(3)氨气溶于水所得的溶液称为氨水.若某氨水的pH=12,则水电离出的c(OH-)=1×10-12mol•L-1,水的电离常数无影响(填“变大”、“变小”或“无影响”);在25℃下,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成Cu(OH)2沉淀(填化学式),生成该沉淀的离子方程式为2NH3•H2O+Cu2+=Cu(OH)2↓+2NH4+.(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(1)如图是1mol NO2和1mol CO 反应生成 CO2和NO的过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)═NO(g)+CO2(g);△H=-234 kJ•mol-1.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)??2NH3(g);△H<0,其化学平衡常数K与T的关系如表所示:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1>K2(填“>”、“=”或“<”).
②下列各项能作为判断该反应达到化学平衡状态依据的是c(填序号).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v正(N2)=3v逆(H2)
c.容器内压强保持不变
d.混合气体的密度保持不变
③400℃时,反应2NH3(g)??N2(g)+3H2(g)的化学平衡常数K为2.当测得NH3、N2、H2的物质的量分别为3mol、2mol、1mol时,则该反应的v正(N2)>v逆(N2)(填“>”、“=”或“<”).
(3)氨气溶于水所得的溶液称为氨水.若某氨水的pH=12,则水电离出的c(OH-)=1×10-12mol•L-1,水的电离常数无影响(填“变大”、“变小”或“无影响”);在25℃下,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成Cu(OH)2沉淀(填化学式),生成该沉淀的离子方程式为2NH3•H2O+Cu2+=Cu(OH)2↓+2NH4+.(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)
12. 为了解决空气污染危机,中国煤炭业制定了“煤制气”计划.工业上可用煤生产合成气(CO和H2),也可用煤制天然气.
为了解决空气污染危机,中国煤炭业制定了“煤制气”计划.工业上可用煤生产合成气(CO和H2),也可用煤制天然气.
(1)已知:①CO(g)+H2O(g)═H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)═CH4(g)△H=-73kJ•mol-1
③2CO(g)═C(s)+CO2(g)△H=-171kJ•mol-1
写出CO2与H2反应生成CH4和H2O的热化学方程式:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-162 kJ•mol-1.
(2)利用合成气可制备新型燃料甲醇:CO(g)+2H2(g)?CH3OH(g)△H,下表所列数据是该反应在不同温度下的化学平衡常数(K).
①由表中数据可判断该反应的△H<0(填“>”、“=”或“<”).
②某温度下,将2mol CO和6mol H2充入2L的恒容密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃(从上表中选择).
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为2CH3OH+3O2+4OH-═2CO32-+6H2O.
 为了解决空气污染危机,中国煤炭业制定了“煤制气”计划.工业上可用煤生产合成气(CO和H2),也可用煤制天然气.
为了解决空气污染危机,中国煤炭业制定了“煤制气”计划.工业上可用煤生产合成气(CO和H2),也可用煤制天然气.(1)已知:①CO(g)+H2O(g)═H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)═CH4(g)△H=-73kJ•mol-1
③2CO(g)═C(s)+CO2(g)△H=-171kJ•mol-1
写出CO2与H2反应生成CH4和H2O的热化学方程式:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-162 kJ•mol-1.
(2)利用合成气可制备新型燃料甲醇:CO(g)+2H2(g)?CH3OH(g)△H,下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的恒容密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃(从上表中选择).
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为2CH3OH+3O2+4OH-═2CO32-+6H2O.
9.室温下,0.1mol/L的二元酸H2A溶液中,溶液体系可能存在的含A粒子(H2A、HA-、A2-)所占物质的量分数随pH变化的关系如图所示,下列说法正确的是( )
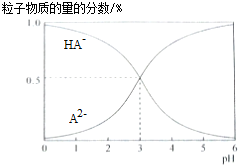

| A. | H2A的电离方程式为:H2A?H++HA- | |
| B. | pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100 | |
| C. | 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为c(Na+)>c(HA-)>c(A2-) | |
| D. | Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+2c(H2A),各粒子浓度均大于0 |
8.碳和氮的许多化合物在工农业生产和生活中有重要的作用.
(1)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2].已知:
①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.5kJ•mol-1
②NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g)△H=+116.5kJ•mol-1
③H2O(l)═H2O(g)△H=+44.0kJ•mol-1
则反应2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)的△H=-87.0kJ•mol-1
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.
在T1℃时,反应进行到同时间测得各物质的浓度如下;30min后,只改变某一条件,反应重新达到平衡,各物质浓度如表所.
①0~10min内,NO的平均反应速率v(NO)=0.042mol•L-1•min-1,T1℃时,该反应的平衡常数K=$\frac{9}{16}$;
②30min后,只改变某一条件,反应重新达到平衡,各物质浓度如表所示.根据上表中的数据判断改变的条件可能是bc(填字母编号).
a.加入一定量的活性炭 b.通入一定量的NO c.适当缩小容器的体积
d.加入合适的催化剂 e.升高温度
③30min后,如果将温度升高至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则 Q<0(填“>”或“<”).
(1)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2].已知:
①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.5kJ•mol-1
②NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g)△H=+116.5kJ•mol-1
③H2O(l)═H2O(g)△H=+44.0kJ•mol-1
则反应2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)的△H=-87.0kJ•mol-1
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.
在T1℃时,反应进行到同时间测得各物质的浓度如下;30min后,只改变某一条件,反应重新达到平衡,各物质浓度如表所.
| 时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,反应重新达到平衡,各物质浓度如表所示.根据上表中的数据判断改变的条件可能是bc(填字母编号).
a.加入一定量的活性炭 b.通入一定量的NO c.适当缩小容器的体积
d.加入合适的催化剂 e.升高温度
③30min后,如果将温度升高至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则 Q<0(填“>”或“<”).
7.运用化学反应原理研究NH3的性质具有重要意义.
(1)科学家一直致力于“人工固氮”的新方法研究.据报道,在光照条件下,N2在催化剂表面与水发生反应生成NH3和另一种单质.在使用催化剂和不使用催化剂时,该反应过程和能量的变化关系如图所示.
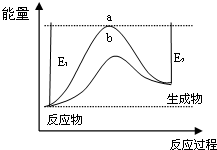
①写出该反应的化学方程式2N2+6H2O$\frac{\underline{\;催化剂\;}}{光照}$4NH3+3O2.
②a和b相比,二者的平衡常数关系是Ka=Kb(填“>”、“=”或“<”).
③升高温度,平衡时NH3的含量增大(填“增大”、“不变”或“减小”).
(2)在 0.5L的密闭容器中,一定量的 N2和H2发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,
400℃时,K=0.5,某一时刻测得N2、H2 和NH3三种物质物质的量分别为2mol、2mol和3mol,则该反应的v正(N2)>v逆(N2)(填“>”“=”或“<”).
(3)将NH3气体通入稀盐酸中,若存在[NH4+]>[Cl-]>[OH-]>[H+]的关系,此时所得溶液的溶质是NH3.H2O、NH4Cl(填化学式).
(4)NH3的催化氧化反应是工业制HNO3的关键步骤,测得某温度下固定容积的容器中的数据为:
①则2~4min内,v(O2)=0.0625mol/(L.min).
②在第8min时改变条件,你认为改变的条件可能是增大NO的浓度.
(1)科学家一直致力于“人工固氮”的新方法研究.据报道,在光照条件下,N2在催化剂表面与水发生反应生成NH3和另一种单质.在使用催化剂和不使用催化剂时,该反应过程和能量的变化关系如图所示.

①写出该反应的化学方程式2N2+6H2O$\frac{\underline{\;催化剂\;}}{光照}$4NH3+3O2.
②a和b相比,二者的平衡常数关系是Ka=Kb(填“>”、“=”或“<”).
③升高温度,平衡时NH3的含量增大(填“增大”、“不变”或“减小”).
(2)在 0.5L的密闭容器中,一定量的 N2和H2发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,
400℃时,K=0.5,某一时刻测得N2、H2 和NH3三种物质物质的量分别为2mol、2mol和3mol,则该反应的v正(N2)>v逆(N2)(填“>”“=”或“<”).
(3)将NH3气体通入稀盐酸中,若存在[NH4+]>[Cl-]>[OH-]>[H+]的关系,此时所得溶液的溶质是NH3.H2O、NH4Cl(填化学式).
(4)NH3的催化氧化反应是工业制HNO3的关键步骤,测得某温度下固定容积的容器中的数据为:
| 浓度/mol•L-1 时间 | c(NH3) | c(O2) | c(NO) |
| 0min | 1.000 | 1.600 | 0.000 |
| 2min | 0.600 | a | 0.400 |
| 4min | 0.500 | 0.975 | 0.500 |
| 6min | 0.500 | 0.975 | 0.500 |
| 8min | 0.700 | 1.225 | 0.750 |
②在第8min时改变条件,你认为改变的条件可能是增大NO的浓度.
6.已知A、B两种元素的原子序数在3~18之间,它们可形成离子化合物AmBn,且离子均具有稀有气体的原子结构,若A的原子序数为a,则B的原子序数不可能是( )
0 167184 167192 167198 167202 167208 167210 167214 167220 167222 167228 167234 167238 167240 167244 167250 167252 167258 167262 167264 167268 167270 167274 167276 167278 167279 167280 167282 167283 167284 167286 167288 167292 167294 167298 167300 167304 167310 167312 167318 167322 167324 167328 167334 167340 167342 167348 167352 167354 167360 167364 167370 167378 203614
| A. | a+8-m-n | B. | a+16-m-n | C. | a-8-(m+n) | D. | a-(m+n) |
 碳氧化物的转化有重大用途,回答关于CO和CO2的问题.
碳氧化物的转化有重大用途,回答关于CO和CO2的问题.
 有机反应中常用镍作催化剂.某镍催化剂中含Ni 64.0%、Al 24.3%、Fe 1.4%,其余为C、H、O、N等元素.
有机反应中常用镍作催化剂.某镍催化剂中含Ni 64.0%、Al 24.3%、Fe 1.4%,其余为C、H、O、N等元素.