��Ŀ����
8��̼�͵�����������ڹ�ũҵ����������������Ҫ�����ã���1����CO2��NH3Ϊԭ�Ͽɺϳɻ�������[��ѧʽΪCO��NH2��2]����֪��
��2NH3��g��+CO2��g���TNH2CO2NH4��s����H=-159.5kJ•mol-1
��NH2CO2NH4��s���TCO��NH2��2��s��+H2O��g����H=+116.5kJ•mol-1
��H2O��l���TH2O��g����H=+44.0kJ•mol-1
��Ӧ2NH3��g��+CO2��g���TCO��NH2��2��s��+H2O��l���ġ�H=-87.0kJ•mol-1
��2���û���̿��ԭ�����Դ����������ij�о�С����ij�ܱ���������һ�����Ļ���̿��NO��������ӦC��s��+2NO��g��?N2��g��+CO2��g����H=Q kJ•mol-1��
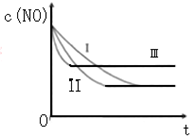
��T1��ʱ����Ӧ���е�ͬʱ���ø����ʵ�Ũ�����£�30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣬������Ũ���������
| ʱ�䣨min�� Ũ�ȣ�mol/L�� | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣬������Ũ�������ʾ�������ϱ��е������жϸı������������bc������ĸ��ţ���
a������һ�����Ļ���̿ b��ͨ��һ������NO c���ʵ���С���������
d��������ʵĴ��� e�������¶�
��30min��������¶�������T2�棬�ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ5��3��3���� Q��0���������������
���� ��1�������Ȼ�ѧ����ʽ��˹���ɣ���+��-�ۼ���õ���
��2���ٷ���ͼ�����ݽ�Ϸ�Ӧ���ʸ����ǵ�λʱ��������Ũ�ȱ仯���㻯ѧ��Ӧ���ʣ�V=$\frac{��c}{��t}$����õ���Ӧ���ʣ�����ƽ��Ũ�ȵõ�ƽ�ⳣ����k=$\frac{c��{N}_{2}��c��C{O}_{2}��}{{c}^{2}��NO��}$��
������ͼ�����ݷ��������ƽ��Ũ�ȼ���ƽ�ⳣ����Ũ�ȱ仯�����жϣ�30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣬C��s��+2NO��g��?N2��g��+CO2��g��������ͼ�����ݷ�����ƽ��״̬����Ũ����������ƽ�ⳣ������K=$\frac{c��{N}_{2}��c��C{O}_{2}��}{{c}^{2}��NO��}$=$\frac{0.36��0.36}{0.4{8}^{2}}$=$\frac{9}{16}$��ƽ�ⳣ�����¶ȱ仯��ƽ�ⳣ������˵���ı������һ�������¶ȣ��������ݷ���������Ũ����������̼��һ������Ũ������Ӧǰ������������䣬���Կ����Ǽ�С��Һ��������һ����һ��������
����30min�������¶���T2�棬�ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮�ȴ�Ϊ5��3��3�������Ͷ�����̼�Ѷ�֮��ʼ��Ϊ1��1������5��3��4��3��˵��ƽ�����淴Ӧ�����ƶ���
��� �⣺��1����2NH3��g��+CO2��g���TNH2CO2NH4��s����H=-159kJ•mol-1
��NH2CO2NH4��S���TCO��NH2��2��s��+H2O��g����H=1165kJ•mol-1
��H2O��l���TH2O��g����H=44.0kJ•mol-1
���ݸ�˹���ɼ���õ�����+��-��
��Ӧ2NH3��g��+CO2��g���TCO��NH2��2��s��+H2O��l����H=-87KJ/mol��
��2����0��10min�ڣ�NO��ƽ����Ӧ����v��NO��=$\frac{1.00mol/L-0.58mol/L}{10min}$=0.042mol•L-1•min-1��
C��s��+2NO��g��?N2��g��+CO2��g����ƽ��Ũ��c��N2��=0.3mol/L��c��CO2��=0.3mol/L��c��NO��=0.4mol/L����Ӧ��ƽ�ⳣ��K=$\frac{c��{N}_{2}��c��C{O}_{2}��}{{c}^{2}��NO��}$=$\frac{0.3��0.3}{0��{4}^{2}}$=$\frac{9}{16}$��
�ʴ�Ϊ��0.042mol•L-1•min-1��$\frac{9}{16}$��
��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣬C��s��+2NO��g��?N2��g��+CO2��g��������ͼ�����ݷ�����ƽ��״̬����Ũ����������ƽ�ⳣ������K=$\frac{c��{N}_{2}��c��C{O}_{2}��}{{c}^{2}��NO��}$=$\frac{0.36��0.36}{0.4{8}^{2}}$=$\frac{9}{16}$��ƽ�ⳣ�����¶ȱ仯��ƽ�ⳣ������˵���ı������һ�������¶ȣ��������ݷ���������Ũ����������̼��һ������Ũ������Ӧǰ������������䣬���Կ����Ǽ�С��Һ��������һ����һ��������
a������һ�����Ļ���̿��̼�ǹ����ƽ����Ӱ�죬ƽ�ⲻ������a����
b��ͨ��һ������NO����ƽ��״̬������ƽ��Ũ������b��ȷ��
c���ʵ���С�������������Ӧǰ��������䣬ƽ��״̬����Ũ������c��ȷ��
d��������ʵĴ���������ֻ�ı仯ѧ��Ӧ���ʣ����ı仯ѧƽ�⣬��d����
�ʴ�Ϊ��bc��
����30min�������¶���T2�棬�ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮�ȴ�Ϊ5��3��3�������Ͷ�����̼�Ѷ�֮��ʼ��Ϊ1��1������5��3��4��3��˵��ƽ�����淴Ӧ�����ƶ���˵���淴Ӧ�����ȷ�Ӧ��������Ӧ�Ƿ��ȷ�Ӧ����ѡ����
�ʴ�Ϊ������
���� ���⿼�����Ȼ�ѧ����ʽ��˹���ɵļ���Ӧ�ã���ѧƽ���Ӱ�����ط�����ѧƽ���ƶ�ԭ����Ӧ�ã�ƽ�ⳣ�������жϣ���Ŀ�Ѷ��еȣ�

| A�� | ��Һ��һ������Na+��I-��CO32- | |
| B�� | ��Һ��һ�������ڵ�ֻ��I-��SO32- | |
| C�� | ֻ���ٽ���һ��ʵ�飬�Ϳ���ȫȷ����Һ����� | |
| D�� | ��Һ��һ������Br-��CO32-�����ٴ���Na+��NH4+�е�һ�� |
 ����β���е���Ҫ��Ⱦ����NO��CO��Ϊ�˼��������Ⱦ���������ͨ�����·�Ӧ����������β����
����β���е���Ҫ��Ⱦ����NO��CO��Ϊ�˼��������Ⱦ���������ͨ�����·�Ӧ����������β������1��2NO��g��+2CO��g���P2CO2��g��+N2��g����H=-746.5KJ/mol ������Ϊʹ�ô�����
��֪��
2C ��s��+O2��g���P2CO��g����H=-221.0KJ/mol
C ��s��+O2��g���PCO2��g����H=-393.5KJ/mol
��N2��g��+O2��g��=2NO��g����H=+180.5kJ•mol-1��
��2��T���£���һ�ݻ�������ܱ������У�ͨ��һ������NO��CO�������崫������ò�ͬʱ��NO��CO��Ũ�����±�
| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C��NO��10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C��CO��10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
A��4.20 B��4.00 C��3.50 D��2.50
�ڸ��ݢ������ݼ���ǰ2s�ڵ�ƽ����Ӧ����v��CO2��=3.75��10-4 mol/��L��s����
�۲�����Ϊ�жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��ab��������ĸ��ţ�
a��2v����CO��=v����N2��
b�������л��������ܶȱ��ֲ���
c�������������ѹǿ����
d��CO2�������������
��3���о���������ʹ�õ���������ʱ����������ıȱ���������ѧ��Ӧ���ʣ������±���Ƶ�ʵ���û��������NO��Ũ����ʱ��t�仯����������ͼ��ʾ��
| ʵ�� ��� | T/��C | NO��ʼŨ ��/10-3mol•L-1 | CO��ʼŨ ��/10-3mol•L-1 | �����ı� �����/m2•g-1 |
| �� | 350 | 1.20 | 5.80 | 124 |
| �� | 280 | 1.20 | 5.80 | 124 |
| �� | 280 | 1.20 | 5.80 | 82 |
��4����֪��COͨ�����Ƶ�������Һ�п�����������ͬʱ�ͷ�һ����ʹʪ��ĺ�ɫʯ����ֽ���������壮ij�¶��£���1L�ܱ������г���1molNO��1molCO����Ӧ�ﵽƽ���ƽ��������ͨ���������Ƶ�������Һ�У�����43.2g Ag������¶��£���Ӧ2NO��g��+2CO��g���P2CO2��g��+N2��g��������Ϊʹ�ô������Ļ�ѧƽ�ⳣ��K=160��
��5��CO����ȼ�ϵ�ص�ȼ������Li2CO3��Na2CO3�������λ����������ʣ�������CO2�Ļ����Ϊ������ȼ�����Ƶ�650��C�¹�����ȼ�ϵ�أ��õ���ܷ�Ӧ����ʽΪ2CO+O2=2CO2 ����ӦʽΪ2CO+2CO32--4e-�T4CO2��
��1����̬��ԭ����6��δ�ɶԵ��ӣ�һ�������ӵĺ�������Ų�ʽΪ1s22s22p63s23p63d54s1����������һ��������ѧʽΪKx[Fe��CN��]Y•3H2O���������������Ļ�ѧʽΪCN-��������廥Ϊ�ȵ��ӵķ�����N2����һ������
��2������KMnO4�ܽ��ױ�����Ϊ�����ᣬ�ױ���̼ԭ�ӵ��ӻ��������Ϊsp3�����ᱽ�����DZ������ͬ���칹�壬���е�ȱ�����͵ö࣬��ԭ���DZ�������Ӽ����������۵㡢�е�����
������ĽṹʽΪ
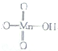 ������ǿ���ǿ�����������ᣮ
������ǿ���ǿ�����������ᣮ��3��Fe3+��H2O�ֽ�Ĵ�������֪���м������ݣ�
| ��ѧ�� | H-O | O-O | O-O |
| ����/��J��mol-1�� | 163 | 142 | 438 |
��2H2O2��l��=2H2O��l��+O2��g�����÷ֽⷴӦΪ�ţ���š����������ȷ�Ӧ��
��4��ÿ����������������2��Crԭ�ӣ�����Crԭ�ӵ���λ��Ϊ8���侧���߳�Ϊ��cm���������Լ�ܶ�Ϊ$\frac{104}{{a}^{3}N{\;}_{A}}$g•cm-3�����ؼ�����������
 ���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã���ش��������⣺
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã���ش��������⣺��1����ͼ��1mol NO2��1mol CO ��Ӧ���� CO2��NO�Ĺ����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽNO2��g��+CO��g���TNO��g��+CO2��g������H=-234 kJ•mol-1��
��2����0.5L���ܱ������У�һ�����ĵ����������������»�ѧ��Ӧ��N2��g��+3H2��g��??2NH3��g������H��0���仯ѧƽ�ⳣ��K��T�Ĺ�ϵ�����ʾ��
| T/�� | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
���ԱȽ�K1��K2�Ĵ�С��K1��K2�����������=����������
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬���ݵ���c������ţ���
a��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2
b��v����N2��=3v����H2��
c��������ѹǿ���ֲ���
d�����������ܶȱ��ֲ���
��400��ʱ����Ӧ2NH3��g��??N2��g��+3H2��g���Ļ�ѧƽ�ⳣ��KΪ2�������NH3��N2��H2�����ʵ����ֱ�Ϊ3mol��2mol��1molʱ����÷�Ӧ��v����N2����v����N2�������������=����������
��3����������ˮ���õ���Һ��Ϊ��ˮ����ij��ˮ��pH=12����ˮ�������c��OH-��=1��10-12mol•L-1��ˮ�ĵ��볣����Ӱ�죨��������С������Ӱ�족������25���£���Ũ�Ⱦ�Ϊ0.1mol•L-1��MgCl2��CuCl2�����Һ����μ��백ˮ��������Cu��OH��2�������ѧʽ�������ɸó��������ӷ���ʽΪ2NH3•H2O+Cu2+=Cu��OH��2��+2NH4+������֪25��ʱKsp[Mg��OH��2]=1.8��10-11��Ksp[Cu��OH��2]=2.2��10-20��
| A�� | �Ȼ��� | B�� | ���� | C�� | С�մ� | D�� | ���� |
 ����-OH��
����-OH��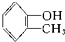 ����-OH��
����-OH��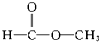 ����
����
 ����
����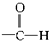
 ijͬѧ���ʵ��֤��ͭ��Ũ�����ܷ�����Ӧ��������������������ʣ���ͼ��ʾ�����Թ������2mLŨ���ᣬ�ô����ܺ�һ��С�Ľ����������ӿ��в���һ��ͭ˿�����ȣ��ѷų�����������ͨ��Ʒ����Һ��ʯ����Һ�У�
ijͬѧ���ʵ��֤��ͭ��Ũ�����ܷ�����Ӧ��������������������ʣ���ͼ��ʾ�����Թ������2mLŨ���ᣬ�ô����ܺ�һ��С�Ľ����������ӿ��в���һ��ͭ˿�����ȣ��ѷų�����������ͨ��Ʒ����Һ��ʯ����Һ�У� +H2$\stackrel{����}{��}$
+H2$\stackrel{����}{��}$ ��
�� ��
��