题目内容
13. 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
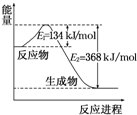
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(1)如图是1mol NO2和1mol CO 反应生成 CO2和NO的过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)═NO(g)+CO2(g);△H=-234 kJ•mol-1.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)??2NH3(g);△H<0,其化学平衡常数K与T的关系如表所示:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1>K2(填“>”、“=”或“<”).
②下列各项能作为判断该反应达到化学平衡状态依据的是c(填序号).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v正(N2)=3v逆(H2)
c.容器内压强保持不变
d.混合气体的密度保持不变
③400℃时,反应2NH3(g)??N2(g)+3H2(g)的化学平衡常数K为2.当测得NH3、N2、H2的物质的量分别为3mol、2mol、1mol时,则该反应的v正(N2)>v逆(N2)(填“>”、“=”或“<”).
(3)氨气溶于水所得的溶液称为氨水.若某氨水的pH=12,则水电离出的c(OH-)=1×10-12mol•L-1,水的电离常数无影响(填“变大”、“变小”或“无影响”);在25℃下,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成Cu(OH)2沉淀(填化学式),生成该沉淀的离子方程式为2NH3•H2O+Cu2+=Cu(OH)2↓+2NH4+.(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)
分析 (1)由图示可知,该反应为放热反应,1mol NO2和1mol CO 反应生成 CO2和NO放出的热量为368-134=234kJ,注明聚集状态与反应热书写热化学方程式;
(2)①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小;
②可逆反应到达平衡时,同一物质的正、逆反应速率相等,各组分的浓度、含量不变,由此衍生的其它一些物理量不变,注意判断平衡状态的物理量应随反应进行而变化,该物理量由变化到不变化,说明反应到达平衡;
③同一可逆反应的正反应平衡常数与逆反应平衡常数互为倒数;
计算浓度商Qc,与平衡常数相比,判断反应进行分析,进而判断v正(N2)、v逆(N2)的相对大小;
(3)溶液中碱电离的氢氧根离子抑制了水电离,碱溶液中c(H+)等于水电离出的c(OH-);
水的离子积只受温度影响,与溶液酸碱性无关;
氢氧化镁与氢氧化铜的结构相似,难溶电解质的溶度积越小,加入氨水时越易生成沉淀.
解答 解:(1)由图示可知,该反应为放热反应,1mol NO2和1mol CO 反应生成 CO2和NO放出的热量为368-134=234kJ,故热化学方程式为:NO2(g)+CO(g)═NO(g)+CO2(g);△H=-234 kJ•mol-1,
故答案为:NO2(g)+CO(g)═NO(g)+CO2(g);△H=-234 kJ•mol-1;
(2))①因该反应是放热反应,反应随着温度的升高,平衡逆向移动,故K1>K2,
故答案为:>;
②a.容器内各物质的浓度之比等于计量数之比,不能证明正逆反应速率相等,与物质的起始浓度及转化率有关,故a错误;
b.不同物质的正、逆反应速率之比等于其计量数之比是平衡状态,故b错误;
c.容器内压强不变,气体的物质的量不变,该反应达平衡状态,故c正确;
d.如果是在密闭容器中反应,质量不变,体积不变,密度始终不变,故d错误;
故选:c;
③两反应书写形式恰好相反,故两反应的化学平衡常数互为倒数,可推知2NH3(g)?N2(g)+3H2(g)的K=$\frac{1}{0.5}$=2,浓度商Qc=$\frac{\frac{2}{0.5}×(\frac{1}{0.5})^{2}}{(\frac{3}{0.5})^{3}}$=$\frac{8}{9}$<2,反应向右进行,故v正(N2)>v逆(N2),
故答案为:2;>;
(3)在pH=12的某碱溶液中,溶液中的氢离子是水电离的,碱溶液中c(H+)等于水电离出的c(OH-),溶液中氢离子浓度为:c(H+)=1×10-12mol/L,所以水电离的氢氧根离子浓度为:1×10-12mol/L;
水的离子积只受温度影响,溶液酸碱性苯乙烯水的电离常数;
由Cu(OH)2的Ksp小于Mg(OH)2的,故Cu(OH)2先沉淀,一水合氨是弱碱,生成Cu(OH)2沉淀的离子方程式为:2NH3•H2O+Cu2+=Cu(OH)2↓+2NH4+,
故答案为:1×10-12;无影响;Cu(OH)2;2NH3•H2O+Cu2+=Cu(OH)2↓+2NH4+.
点评 本题考查较综合,属于拼合型题目,涉及热化学方程式书写、平衡常数影响因素及应用、平衡状态判断、水的电离、溶度积有关计算等,侧重对学生分析与应用能力的考查,题目难度中等.

| A. |  能发生消去反应、酯化反应和加成反应 能发生消去反应、酯化反应和加成反应 | |
| B. | 硫酸铵溶液可以使蛋白质变性 | |
| C. | C4H10与C10H22一定互为同系物 | |
| D. | 分子式为C4H10O的有机物共2种 |
| 时间/s | 0 | 50 | 100 | 150 |
| c(N2O5)/mol.L-1 | 2.50 | 1.76 | 1.25 | 1.25 |
| A. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | |
| B. | 50s内N2O5分解速率为1.48×10-2mol.L-1.s-1 | |
| C. | T1温度下的平衡常数为K1=15.625,平衡时N2O5的转化率为50% | |
| D. | 达到平衡后其他 条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,则c(N2O5)>2.50mol.L-1 |
(1)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2].已知:
①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.5kJ•mol-1
②NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g)△H=+116.5kJ•mol-1
③H2O(l)═H2O(g)△H=+44.0kJ•mol-1
则反应2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)的△H=-87.0kJ•mol-1
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.
在T1℃时,反应进行到同时间测得各物质的浓度如下;30min后,只改变某一条件,反应重新达到平衡,各物质浓度如表所.
| 时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,反应重新达到平衡,各物质浓度如表所示.根据上表中的数据判断改变的条件可能是bc(填字母编号).
a.加入一定量的活性炭 b.通入一定量的NO c.适当缩小容器的体积
d.加入合适的催化剂 e.升高温度
③30min后,如果将温度升高至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则 Q<0(填“>”或“<”).
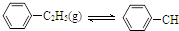 =CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )
=CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )经一段时间后达到平衡.反应过程中测定的部分数据见下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50% | |
| B. | 反应在前20 min的平均速率为v(H2)=0.004mol•L-1•min-1 | |
| C. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol•L-1,则a<0 | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v(正)>v(逆) |
| A. | ① | B. | ②③ | C. | ①②③ | D. | ①③ |
| A. | 由极性键构成的极性分子 | B. | 由极性键构成的非极性分子 | ||
| C. | 由非极性键构成的极性分子 | D. | BeCl2中Be采取sp2杂化 |
 $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$ +HCl,下列是由苯制取有机物“茚”的反应过程:
+HCl,下列是由苯制取有机物“茚”的反应过程: $\stackrel{SOCl_{2}}{→}$
$\stackrel{SOCl_{2}}{→}$ $→_{②}^{博.克反应}$X$→_{③}^{H_{2}/催化剂}$
$→_{②}^{博.克反应}$X$→_{③}^{H_{2}/催化剂}$ $→_{④}^{浓H_{2}SO_{4}/△}$茚
$→_{④}^{浓H_{2}SO_{4}/△}$茚 、茚
、茚 ;
; 互为同分异构体,有一苯环且苯环上有互为对位的2个取代基,并能与NaOH反应的有机物的结构简式(写出三种)
互为同分异构体,有一苯环且苯环上有互为对位的2个取代基,并能与NaOH反应的有机物的结构简式(写出三种) .
. 有下列性质AD
有下列性质AD 的合成路线流程图(其他无机试剂任选).
的合成路线流程图(其他无机试剂任选).