题目内容
7.运用化学反应原理研究NH3的性质具有重要意义.(1)科学家一直致力于“人工固氮”的新方法研究.据报道,在光照条件下,N2在催化剂表面与水发生反应生成NH3和另一种单质.在使用催化剂和不使用催化剂时,该反应过程和能量的变化关系如图所示.
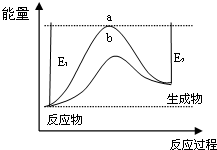
①写出该反应的化学方程式2N2+6H2O$\frac{\underline{\;催化剂\;}}{光照}$4NH3+3O2.
②a和b相比,二者的平衡常数关系是Ka=Kb(填“>”、“=”或“<”).
③升高温度,平衡时NH3的含量增大(填“增大”、“不变”或“减小”).
(2)在 0.5L的密闭容器中,一定量的 N2和H2发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,
400℃时,K=0.5,某一时刻测得N2、H2 和NH3三种物质物质的量分别为2mol、2mol和3mol,则该反应的v正(N2)>v逆(N2)(填“>”“=”或“<”).
(3)将NH3气体通入稀盐酸中,若存在[NH4+]>[Cl-]>[OH-]>[H+]的关系,此时所得溶液的溶质是NH3.H2O、NH4Cl(填化学式).
(4)NH3的催化氧化反应是工业制HNO3的关键步骤,测得某温度下固定容积的容器中的数据为:
| 浓度/mol•L-1 时间 | c(NH3) | c(O2) | c(NO) |
| 0min | 1.000 | 1.600 | 0.000 |
| 2min | 0.600 | a | 0.400 |
| 4min | 0.500 | 0.975 | 0.500 |
| 6min | 0.500 | 0.975 | 0.500 |
| 8min | 0.700 | 1.225 | 0.750 |
②在第8min时改变条件,你认为改变的条件可能是增大NO的浓度.
分析 (1)①N2在催化剂表面与水发生反应生成NH3和另一种单质,由元素守恒可知生成单质为氧气,配平书写化学方程式;
②b与a相比,改变反应途径,降低活化能,应是使用催化剂,催化剂不影响平衡移动;
③由图可知,该反应为放热反应,升高温度,平衡向逆反应移动,由2N2(g)+6H2O(l)$\frac{\underline{\;催化剂\;}}{光照}$4NH3(g)+3O2(g),可知1mol氨气反应时,混合气体总物质的量减小$\frac{5}{3}$mol;
(2)计算浓度商Qc,与平衡常数相比,判断反应进行的方向,进而判断v正(N2)、v逆(N2)相对大小;
(3)将NH3气体通入稀盐酸中,反应生成氯化铵,而氯化铵中铵根离子水解,使溶液呈酸性,若溶液中存在[NH4+]>[Cl-]>[OH-]>[H+],则溶液呈碱性,反应中氨气过量;
(4)①根据v=$\frac{△c}{△t}$计算v(NH3),再利用速率之比等于其化学计量数之比计算v(O2);
②由表中数据可知,8min与6min相比,氨气浓度增大0.2mol/L、氧气浓度增大0.25mol/L,NO浓度增大0.25mol,发生反应4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,氨气、氧气浓度增大量之比等于化学计量数之比,且8min时氨气、氧气、氮气浓度之比不等于平衡时的浓度之比,不是增大压强,只能为增大NO的浓度.
解答 解:(1)①N2在催化剂表面与水发生反应生成NH3和另一种单质,由元素守恒可知生成单质为氧气,该反应方程式为:2N2+6H2O$\frac{\underline{\;催化剂\;}}{光照}$4NH3+3O2,
故答案为:2N2+6H2O$\frac{\underline{\;催化剂\;}}{光照}$4NH3+3O2;
②b与a相比,改变反应途径,降低活化能,应是使用催化剂,催化剂不影响平衡移动,平衡常数不变,即平衡常数Ka=Kb,
故答案为:=;
③由图可知,该反应为放热反应,升高温度,平衡向逆反应移动,由2N2(g)+6H2O(l)$\frac{\underline{\;催化剂\;}}{光照}$4NH3(g)+3O2(g),平衡时氨气物质的量减小,混合气体总物质的量减小,且1mol氨气反应时,总物质的量减小$\frac{5}{3}$mol,故平衡时NH3的含量增大,
故答案为:增大;
(2)在 0.5L的密闭容器中,一定量的 N2和H2发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,400℃时,K=0.5,某一时刻测得N2、H2 和NH3三种物质物质的量分别为2mol、21mol和3mol,浓度商Qc=$\frac{(\frac{3}{0.5})^{2}}{\frac{2}{0.5}×({\frac{2}{0.5})}^{3}}$=$\frac{9}{64}$<K=0.5,反应向正反应进行,故v正(N2)>v逆(N2),
故答案为:>;
(3)将NH3气体通入稀盐酸中,反应生成氯化铵,而氯化铵中铵根离子水解,使溶液呈酸性,若溶液中存在[NH4+]>[Cl-]>[OH-]>[H+],则溶液呈碱性,反应中氨气过量,故反应后溶液中溶质为NH3.H2O、NH4Cl,
故答案为:NH3.H2O、NH4Cl;
(4)①由表中数据可知,2~4min内氨气浓度变化量为0.6mol/L-0.5mol/L=0.1mol/L,故v(NH3)=$\frac{0.1mol/L}{2min}$=0.05mol/(L.min),发生反应4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,速率之比等于其化学计量数之比,则v(O2)=$\frac{5}{4}$v(NH3)=$\frac{5}{4}$×0.05mol/(L.min)=0.0625mol/(L.min),
故答案为:0.0625mol/(L.min);
②由表中数据可知,6min平衡状态,8min与6min相比,氨气浓度增大0.2mol/L、氧气浓度增大0.25mol/L,NO浓度增大0.25mol,发生反应4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,氨气、氧气浓度增大量之比等于化学计量数之比,且8min时氨气、氧气、氮气浓度之比不等于平衡时的浓度之比,不是增大压强,只能为增大NO的浓度,
故答案为:增大NO的浓度.
点评 本题属于拼合型题目,涉及化学方程式书写、平衡常数影响因素与应用、化学平衡计算、化学反应速率计算,(1)③为易错点,学生容易认为“平衡向逆反应进行,氨气的含量减小”,(4)中注意分析浓度变化判断改变的条件,难度中等.

| A. | 高温下二氧化硅与碳酸钠反应放出二氧化碳,说明硅酸(H2SiO3)的酸性比碳酸强 | |
| B. | 陶瓷、玻璃、水泥容器都能贮存氢氟酸 | |
| C. | 石灰抹墙、水泥砌墙的硬化过程原理不相同 | |
| D. | 硫酸钠溶液、烧碱溶液、硝酸溶液、浓硫酸四种溶液均能用带玻璃塞的试剂瓶保存 |
 为了解决空气污染危机,中国煤炭业制定了“煤制气”计划.工业上可用煤生产合成气(CO和H2),也可用煤制天然气.
为了解决空气污染危机,中国煤炭业制定了“煤制气”计划.工业上可用煤生产合成气(CO和H2),也可用煤制天然气.(1)已知:①CO(g)+H2O(g)═H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)═CH4(g)△H=-73kJ•mol-1
③2CO(g)═C(s)+CO2(g)△H=-171kJ•mol-1
写出CO2与H2反应生成CH4和H2O的热化学方程式:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-162 kJ•mol-1.
(2)利用合成气可制备新型燃料甲醇:CO(g)+2H2(g)?CH3OH(g)△H,下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的恒容密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃(从上表中选择).
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为2CH3OH+3O2+4OH-═2CO32-+6H2O.
 已知CO和H2在一定条件下合成甲醇的反应为CO(g)+2H2(g)?CH3OH(g),现在容积固定且相等的a、b、c三个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度进行反应,测得相关数据的关系如图所示.下列说法正确的是( )
已知CO和H2在一定条件下合成甲醇的反应为CO(g)+2H2(g)?CH3OH(g),现在容积固定且相等的a、b、c三个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度进行反应,测得相关数据的关系如图所示.下列说法正确的是( )| A. | a容器中,0~5min反应速率v(H2)=0.08mol•L-1•min-1 | |
| B. | 反应进行到5min时,b容器中v正=v速 | |
| C. | 其他条件不变时,减压可将b中的状态转变成c中的状态 | |
| D. | 达到平衡时a、b、c容器中的转化率为b>a>c |
 研究碳及其化合物的性质对于科研、生产生活具有重要意义.
研究碳及其化合物的性质对于科研、生产生活具有重要意义.