题目内容
6.已知A、B两种元素的原子序数在3~18之间,它们可形成离子化合物AmBn,且离子均具有稀有气体的原子结构,若A的原子序数为a,则B的原子序数不可能是( )| A. | a+8-m-n | B. | a+16-m-n | C. | a-8-(m+n) | D. | a-(m+n) |
分析 已知A、B两元素的原子序数在3~18之间,它们可形成离子化合物,则A为活泼金属,B为活泼非金属,举例进行判断,得出正确结论.
解答 解:A.若AmBn为MgCl2,则a=12,m=1,n=2,则B的原子序数为12+8-1-2=17,故A可能;
B.若AmBn为BeCl2,则a=4,m=1,n=2,则B的原子序数为4+16-1-2=17,故BC可能;
C.若金属离子在同周期,离子的核外电子数目相差8,则a-n+8=x+m,即x=a+8-m-n,故C不可能;
D.若AmBn为Na2O,则a=11,m=2,n=1,则B的原子序数为11-2-1=8,故D可能,
故选C.
点评 本题考查根据化学式判断化合物中原子序数的数量关系,难度中等.根据题意举出实例是解题的关键.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
19.月球的矿产资源极为丰富,仅月球表层5cm厚的沙土就含铁单质有上亿吨,月球上的主要矿物有辉石[CaMgSi2O6]、斜长石[KAlSi3O8]和橄榄石[MgFeSiO4]等,下列说法或分析不正确的是( )
| A. | 辉石、斜长石及橄榄石均属于硅酸盐矿 | |
| B. | 斜长石的氧化物形式可表示为:K2O•Al2O3•6SiO2 | |
| C. | 橄榄石中铁为+2价 | |
| D. | 月球上有游离态铁是因为月球上铁的活性比地球上铁的活动性弱 |
17.随着环保意识增强,清洁能源越来越受到人们关注.甲烷是一种较为理想的洁净燃料.以下是利用化学反应原理中的有关知识对甲烷转化问题的研究.
(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ•mol-1
H2O(l)═H2O(g),△H=+44.0kJ•mol-1
则1.6g甲烷气体完全燃烧生成液态水,放出热量为89.03kJ.
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值.该反应可表示为CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ•mol-1.为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101kPa或303kPa,其余实验条件见下表).
表中t=480,p=303;设计实验2、3的目的是探究温度对化学反应速率的影响.实验1、2、3中反应的化学平衡常数的大小关系是K2>K1=K3(用K1、K2、K3表示).
(3)若800℃时,反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ•mol-1的平衡常数(K)=1.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表:
则此时正、逆反应速率的关系是C(填标号)
A.v(正)<v(逆) B.v(正)=v(逆) C.v(正)>v(逆) D.无法判断.
(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ•mol-1
H2O(l)═H2O(g),△H=+44.0kJ•mol-1
则1.6g甲烷气体完全燃烧生成液态水,放出热量为89.03kJ.
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值.该反应可表示为CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ•mol-1.为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101kPa或303kPa,其余实验条件见下表).
| 实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/mol•L-1 | H2O初始浓度/mol•L-1 |
| 1 | 360 | p | 2.00 | 6.80 |
| 2 | t | 101 | 2.00 | 6.80 |
| 3 | 360 | 101 | 2.00 | 6.80 |
(3)若800℃时,反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ•mol-1的平衡常数(K)=1.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表:
| CH4 | H2O | CO | H2 |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
A.v(正)<v(逆) B.v(正)=v(逆) C.v(正)>v(逆) D.无法判断.
14.在10L恒容密闭容器中发生反应:X(g)+Y(g)?2Z(g)△H<0.T℃时,各物质的物质的量与时间关系如下表:下列说法正确的是( )
| 时间/min | n(X)/mol | n(Y)/mol | n(Z)/mol |
| 0 | 0.20 | 0.60 | 0 |
| 10 | a1 | a2 | 0.25 |
| 13 | b1 | 0.45 | b2 |
| 15 | d1 | d2 | 0.30 |
| A. | 前10 min内的平均反应速率v(Y)=2.5×10-3 mol/(L•min) | |
| B. | 保持其它条件不变,升高温度,反应达平衡时c(X)<5.0×10-3 mol/L | |
| C. | 若起始时只充入0.60 mol Z(g),反应达平衡时Z(g)的转化率为50% | |
| D. | 若起始时充入0.60 mol X(g)、0.10 mol Y(g)和0.50 mol Z(g),达到平衡前v(正)>v(逆) |
18.900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: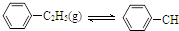 =CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )
=CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )
经一段时间后达到平衡.反应过程中测定的部分数据见下表:
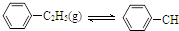 =CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )
=CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )经一段时间后达到平衡.反应过程中测定的部分数据见下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50% | |
| B. | 反应在前20 min的平均速率为v(H2)=0.004mol•L-1•min-1 | |
| C. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol•L-1,则a<0 | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v(正)>v(逆) |
15.已知苯跟一卤代烷在催化剂作用下可生成苯的同系物.如: 在催化剂作用下,由苯和下列各组物质合成乙苯最好应选用的是( )
在催化剂作用下,由苯和下列各组物质合成乙苯最好应选用的是( )
 在催化剂作用下,由苯和下列各组物质合成乙苯最好应选用的是( )
在催化剂作用下,由苯和下列各组物质合成乙苯最好应选用的是( )| A. | CH3-CH3和Cl2 | B. | CH2=CH2和Cl2 | C. | CH2=CH2和HCl | D. | CH≡CH和Cl2 |
16.某化学兴趣小组的同学们将稀硫酸逐渐加入氢氧化铜固体中,至氢氧化铜恰好完全溶解.
(1)该反应的化学方程式是Cu(OH)2+H2SO4═CuSO4+2H2O.
(2)兴趣小组的同学们欲利用上述反应后的剩余溶液探究中和反应的微观本质.
【猜想与假设】
猜想①:中和反应的微观本质是金属阳离子(铜离子)与酸根离子(硫酸根离子)结合生成盐(硫酸铜).
猜想②:中和反应的微观本质是另外两种离子即氢离子和氢氧根离子结合生成了水.
【实验验证】
【反思与评价】
小亮认为不用进行方案l即可直接判断猜想①,理由是稀硫酸与氢氧化铜反应后的溶液呈蓝色,说明铜离子并没有被结合.
(1)该反应的化学方程式是Cu(OH)2+H2SO4═CuSO4+2H2O.
(2)兴趣小组的同学们欲利用上述反应后的剩余溶液探究中和反应的微观本质.
【猜想与假设】
猜想①:中和反应的微观本质是金属阳离子(铜离子)与酸根离子(硫酸根离子)结合生成盐(硫酸铜).
猜想②:中和反应的微观本质是另外两种离子即氢离子和氢氧根离子结合生成了水.
【实验验证】
| 方案 | 实验步骤 | 实验现象 | 结论 | 有关反应的化学方程式 |
| 1 | 取少量待测溶液,向其中滴加适量BaCl2溶液 | |||
| 2 | 猜想②正确 | 无 |
小亮认为不用进行方案l即可直接判断猜想①,理由是稀硫酸与氢氧化铜反应后的溶液呈蓝色,说明铜离子并没有被结合.
 $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$ +HCl,下列是由苯制取有机物“茚”的反应过程:
+HCl,下列是由苯制取有机物“茚”的反应过程: $\stackrel{SOCl_{2}}{→}$
$\stackrel{SOCl_{2}}{→}$ $→_{②}^{博.克反应}$X$→_{③}^{H_{2}/催化剂}$
$→_{②}^{博.克反应}$X$→_{③}^{H_{2}/催化剂}$ $→_{④}^{浓H_{2}SO_{4}/△}$茚
$→_{④}^{浓H_{2}SO_{4}/△}$茚 、茚
、茚 ;
; 互为同分异构体,有一苯环且苯环上有互为对位的2个取代基,并能与NaOH反应的有机物的结构简式(写出三种)
互为同分异构体,有一苯环且苯环上有互为对位的2个取代基,并能与NaOH反应的有机物的结构简式(写出三种) .
. 有下列性质AD
有下列性质AD 的合成路线流程图(其他无机试剂任选).
的合成路线流程图(其他无机试剂任选). 碳氧化物的转化有重大用途,回答关于CO和CO2的问题.
碳氧化物的转化有重大用途,回答关于CO和CO2的问题.