题目内容
11. 碳氧化物的转化有重大用途,回答关于CO和CO2的问题.
碳氧化物的转化有重大用途,回答关于CO和CO2的问题.(1)己知:①C (s)+H2O(g)?CO (g)+H2 (g)△H1
②2CO(g)+O2(g)=2CO2 (g)△H2
③H2O (g)=H2 (g)+$\frac{1}{2}$O2 (g)△H3
则C (s)+O2(g)=CO2 (g)的△H=(△H1+$\frac{1}{2}$△H2-△H3 )KJ/mol(用△H1、△H2、△H3表示).
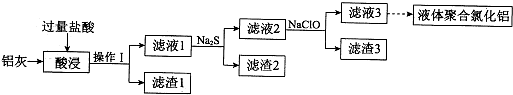
(2)对于化学平衡①,在不同温度下,CO的浓度与反应时间的关系如图所示,由图可得出如下规律:
随着温度升高,
①在同一时间CO的生成浓度大
②反应的速率加快,达到平衡的时间缩短,温度升高平衡正向进行,正反应为吸热反应
(3)某温度下,将6.0mol H2O(g)和足量碳充入3L的恒容密闭容器中,发生如下反应:C (s)+H2O(g)?CO (g)+H2 (g),达到平衡时测得lgK=-1.0(K为平衡常数),求平衡时H2O(g)的转化率?(写出计算过程)
分析 (1)依据热化学方程式和盖斯定律计算得到热化学方程式,①+$\frac{1}{2}$②-③;
(2)分析图象中曲线的变化和随温度变化的一氧化碳浓度结合平衡移动原理归纳存在的规律;
(3)依据化学平衡三段式列式计算,假设H2O(g)转化了x mol/L,lgK=-1.0,K=0.1,依题意有:
C (s)+H2O(g)?CO (g)+H2 (g)
起始浓度(mol/L) 2.0 0 0
转化浓度(mol/L) x x x
平衡浓度(mol/L) 2.0-x x x
结合平衡常数计算转化率=$\frac{消耗量}{起始量}$×100%;
解答 解:(1)①C (s)+H2O(g)?CO (g)+H2 (g)△H1
②2CO(g)+O2(g)=2CO(g)△H2
③H2O (g)=H2 (g)+$\frac{1}{2}$O2 (g)△H3
依据盖斯定律[①×2-③×2+②]×$\frac{1}{2}$得到,C (s)+O2(g)=CO2 (g)的△H=$\frac{1}{2}$(△H1-△H3+△H2)KJ/mol=(△H1+$\frac{1}{2}$△H2-△H3)KJ/mol;
故答案为:(△H1-△H3+△H2)KJ/mol;
(2)对于化学平衡①,在不同温度下,CO的浓度与反应时间的关系如图所示,由图可得出如下规律:
随着温度升高一氧化碳浓度越大,反应速率越大,达到平衡的时间短,温度升高平衡正向进行,正反应为吸热反应;
故答案为:同一时间一氧化碳生成浓度越大,反应速率越大,达到平衡的时间短;温度升高平衡正向进行,正反应为吸热反应;
(3)某温度下,将6.0mol H2O(g)和足量碳充入3L的恒容密闭容器中,发生如下反应,设消耗水蒸气浓度为x:
C(s)+H2O(g)?CO(g)+H2(g),
起始量(mol/L) 2 0 0
变化量(mol/L) x x x
平衡量(mol/L) 2-x x x
达到平衡时测得lgK=-1.0(K为平衡常数),K=0.1
由K=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$=$\frac{{x}^{2}}{2.0-x}$=0.1,
解得x=0.4;
所以H2O(g)转化率为$\frac{0.4mol/L}{2mol/L}$ x100%=20%;
答:H2O(g)转化率为20%.
点评 本题考查了化学平衡的计算方法和分析应用,热化学方程式书写,主要是平衡常数、转化率的计算分析,掌握基础是关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案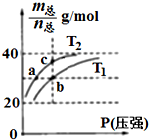 已知(HF)2(g)?2HF(g),△H>0,且平衡体系的总质量[m(总)]与总物质的量[n(总)]之比在不同温度下随压强的变化曲线如图所示.下列说法正确的是( )
已知(HF)2(g)?2HF(g),△H>0,且平衡体系的总质量[m(总)]与总物质的量[n(总)]之比在不同温度下随压强的变化曲线如图所示.下列说法正确的是( )| A. | 温度:T1<T2 | |
| B. | 平衡常数:K(a)=K(b)<K(c) | |
| C. | 反应速率:Vb>Va | |
| D. | 当$\frac{m(总)}{n(总)}$=30g/mol时,n(HF):n(HF)2=2:1 |
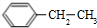 (g)?
(g)?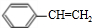 (g)+H2(g)△H=a kJ•mol-1.经一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
(g)+H2(g)△H=a kJ•mol-1.经一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 反应在前20 min的平均速率为v(H2)=0.004mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol•L-1,则a<0 | |
| C. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0% | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v(正)>v(逆) |
| A. | a+8-m-n | B. | a+16-m-n | C. | a-8-(m+n) | D. | a-(m+n) |
| 容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
| CO | H2O | CO2 | H2 | ||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
| ② | 0 | 0 | 1 | 4 | 热量变化:Q |
| A. | 容器①中反应达平衡时,CO的转化率为80% | |
| B. | 容器①中CO的转化率等于容器②中CO2的转化率 | |
| C. | 容器①中CO反应速率等于H2O的反应速率 | |
| D. | 平衡时,两容器中CO2的浓度相等 |
①甲跟水反应比乙与水反应剧烈
②甲单质能从乙的盐溶液中置换出单质乙
③甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强
④与某非金属反应时甲原子失电子数目比乙的多
⑤以甲、乙金属为电极构成原电池,甲作负极.
| A. | ①④ | B. | ③⑤ | C. | ①②③④⑤ | D. | ①②③⑤ |
| A. | n=2x=y | B. | n=x/2=y | C. | n=x=2y | D. | x=2n=y |
| A. | 0.1mol/LCH3COOH溶液中:c(CH3COO-)=c(H+) | |
| B. | 水离出来的c(H+)=l.0×10-13 mol/L的溶液中,Al3+可能大量存在 | |
| C. | 0.1 mol/LNaHCO3溶液中:c(Na+)=c(HCO3- )+2c(CO3 2-)+c(H2CO3) | |
| D. | O.lmol/L的氨水中滴加稀盐酸至过量,不可能有:c(Cl-)>c(NH4 +)>c(H+)>c(OH-) |