题目内容
9.室温下,0.1mol/L的二元酸H2A溶液中,溶液体系可能存在的含A粒子(H2A、HA-、A2-)所占物质的量分数随pH变化的关系如图所示,下列说法正确的是( )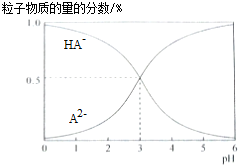
| A. | H2A的电离方程式为:H2A?H++HA- | |
| B. | pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100 | |
| C. | 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为c(Na+)>c(HA-)>c(A2-) | |
| D. | Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+2c(H2A),各粒子浓度均大于0 |
分析 A、二元酸H2A溶液中不存在H2A分子,说明第一步完全电离,二元酸H2A的电离方程式为:H2A=H++HA- HA-?H++A2-;
B、据图象分析,pH=3时,c(HA-)与c(A2-)相同,pH=5时,c(HA-):c(A2-)=1:100;
C、不知道HA-的电离程度与A2-的水解程度哪个更大;
D、Na2A溶液中不存在H2A分子.
解答 解:A、二元酸H2A溶液中不存在其分子,说明第一步完全电离,二元酸H2A的电离方程式为:H2A=H++HA-,HA-?H++A2-,故A错误;
B、据图象分析,pH=3时,c(HA-)与c(A2-)相同,pH=5时,c(HA-):c(A2-)=1:100,故B正确;
C、等物质的量浓度的NaHA和Na2A溶液等体积混合后,无法比较c(HA-)与c(A2-)的大小,故C错误;
D、二元酸H2A的电离方程式为:H2A=H++HA-,HA-?H++A2-,Na2A溶液中不存在H2A分子,c(H2A)=0,故D错误;
关系B.
点评 本题考查了据图象分析二元酸的电离特点,关键是从图象分析出第一步完全电离,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.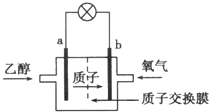 在2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇(CH3OH)电池效率高出32倍,且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图所示,下列说法中正确的是( )
在2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇(CH3OH)电池效率高出32倍,且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图所示,下列说法中正确的是( )
 在2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇(CH3OH)电池效率高出32倍,且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图所示,下列说法中正确的是( )
在2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇(CH3OH)电池效率高出32倍,且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图所示,下列说法中正确的是( )| A. | a极为电池的正极 | |
| B. | 电池工作时电子由b极沿导线经灯泡再到a极 | |
| C. | 电池正极的电极反应为:4H++O2+4e-=2H2O | |
| D. | 电池工作时,1 mol乙醇被氧化时就有6 mol电子转移 |
20.一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
| A. | 以X浓度变化表示的反应速率为0.001 mol/(L•s) | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 其他条件不变时,若增大压强,则物质Y的转化率减小 | |
| D. | 其他条件不变时,若升高温度,X的体积分数增大,则该反应的△H>0 |
17.填写下表:
| 类 别 | 典型代表物名称 | 官能团名称 | 结构简式 |
| 醇 | 乙醇 | 羟基 | CH3CH2OH |
| 酚 | 苯酚 | 羟基 |  |
| 醛 | 乙醛 | 醛基 | CH3CHO |
| 羧酸 | 乙酸 | 羧基 | CH3COOH |
4.将三种黑色粉末组成的混和物加入到100mL 14mol/L某热浓酸中,充分反应后得到蓝绿色溶液和两种气体;将从蓝绿色溶液中分离得到的盐与0.15mol还原铁粉恰好反应完全,可得浅绿色溶液和6.4g红色沉淀;将上述生成的两种气体通入足量饱和NaHCO3溶液中,仍然收集到两种气体,据此推断黑色粉末可能为( )
| A. | 物质的量 FeS:CuO:Fe=1:1:1 | |
| B. | 物质的量 C:CuO:Fe=3:2:2 | |
| C. | 质量 MnO2:CuO:C=5.5:8:1.2 | |
| D. | 质量 Fe:C:CuO=7:5:3 |
14.臭氧是理想的烟气脱硝剂,其脱销反应为:2NO2(g)+O3(g)?N2O5(g)+O2(g),在T温度下,向2.0L恒容密闭容器中充入2.0molNO2和1.0molO3,经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
下列有关说法正确的是( )
| t/s | 0 | 3 | 6 | 12 | 24 |
| n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
| A. | 反应在0~3s的平均速率为v(NO2)=0.24mol•L-1•s-1 | |
| B. | 24s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44mol•L-1,则反应的△H<0 | |
| C. | 在T温度下,起始时向容器中充入1.0molNO2、0.5molO3和0.50molN2O5、0.50molO2,反应达到平衡时,压强为起始的0.88倍 | |
| D. | 在T温度下,起始时向容器中充入2.0molN2O5和2.0molO2,达到平衡时,N2O5的转化率大于20% |
1.下列离子方程式正确的是( )
| A. | 铁与稀硝酸反应:Fe+2H+=Fe2++H2↑ | |
| B. | CuSO4与Ba (OH)2溶液混合 Cu2++SO42-+2OH-+Ba2+=BaSO4↓+Cu(OH)2↓ | |
| C. | 氯化钙与碳酸氢钾溶液混合:Ca2++CO32-=CaCO3↓ | |
| D. | 小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O |
18.有A、B两种烃,相关信息如下:
回答下列问题:
(1)烃A的最简式CH,结构简式
(2)烃B同一碳原子上的二溴取代物的结构简式CHBr2CH(CH3)2
(3)烃C为烃B的同系物,其碳原子数大于B但小于10,其一溴取代物只有一种,该烃的系统命名法名称可能为2,2,3,3-四甲基丁烷.
| A | ①28<M(A)<60 ②不能使溴的四氯化碳溶液褪色 ③其一氯取代物只有一种 ④完全燃烧产物中CO2和H2O物质的量之比2:1 |
| B | ①饱和链烃,通常情况下呈气态 ②有同分异构体 ③其二溴取代物有三种 |
(1)烃A的最简式CH,结构简式

(2)烃B同一碳原子上的二溴取代物的结构简式CHBr2CH(CH3)2
(3)烃C为烃B的同系物,其碳原子数大于B但小于10,其一溴取代物只有一种,该烃的系统命名法名称可能为2,2,3,3-四甲基丁烷.
19.硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质( )
| A. | 锌粉 | B. | 镁粉 | C. | 铁粉 | D. | 铝粉 |