17.一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )
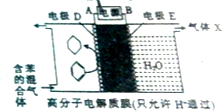

| A. | 电极D的电极反应式为C6H6+6H++6e-=C6H12 | |
| B. | 气体X在反应中通常体现还原性 | |
| C. | 电极D为惰性电极,E为活泼电极 | |
| D. | 外电路电子的移动方向:A→电源→B |
16. 1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( )
1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( )
①苯在铁作催化剂时与液溴发生取代反应,不因发生加成反应而使溴水褪色
②苯在一定条件下能与H2发生加成反应
③邻二溴苯只有一种
④苯中的碳碳键的键长均相等
⑤苯不能使酸性高锰酸钾溶液褪色.
 1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( )
1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( ) ①苯在铁作催化剂时与液溴发生取代反应,不因发生加成反应而使溴水褪色
②苯在一定条件下能与H2发生加成反应
③邻二溴苯只有一种
④苯中的碳碳键的键长均相等
⑤苯不能使酸性高锰酸钾溶液褪色.
| A. | ①③⑤ | B. | ①②③④⑤ | C. | ①③④⑤ | D. | ②④ |
14.以下实验装置正确,且能达到实验目的是( )
| A. | 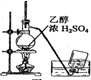 制备乙烯 | B. | 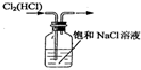 除去Cl2中的HCl | ||
| C. | 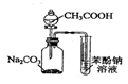 证明酸性:CH3COOH>H2CO3>苯酚 | D. | 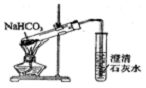 探究NaHCO3的热稳定性 |
13.已知奥运会吉祥物的内充物为涤纶(结构简式为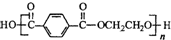 ,外用材料是纯羊毛线.则下列有关说法不正确的是( )
,外用材料是纯羊毛线.则下列有关说法不正确的是( )
 ,外用材料是纯羊毛线.则下列有关说法不正确的是( )
,外用材料是纯羊毛线.则下列有关说法不正确的是( )| A. | 羊毛的主要成分属于蛋白质 | |
| B. | 涤纶属于天然高分子化合物 | |
| C. | 合成涤纶的单体之一可以是HOCH2CH2OH | |
| D. | 可用灼烧的方法区别羊毛和涤纶 |
12.关于实现下列物品用途的主要物质的说法,不正确的是( )
| A. | 硫酸是铅蓄电池的电解质溶液,铅蓄电池可实现化学能转变成电能 | |
| B. | 硅酸干凝胶是硅酸干燥剂的主要成分,作用是吸收水分 | |
| C. | 肥皂的主要成分是硬脂酸钠,可以用于除去油污 | |
| D. | 二氧化硅是光能转化为电能的转化材料 |
11.工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
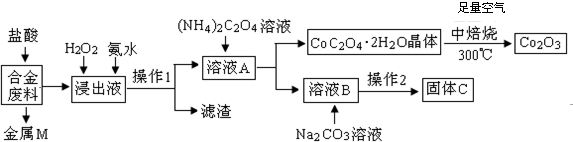
(1)金属M为Cu,操作1为过滤.
(2)加入H2O2的作用是(用离子方程式表示)2Fe2++H2O2+2H+=2Fe3++2H2O,加入氨水的作用是调节PH使Fe3+全部转化为氢氧化铁沉淀.
(3)由CoC2O4•2H2O转化为Co2 O3的化学方程式是4(CoC2O4?2H2O)+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8H2O+8CO2.
(4)知Li2CO3微溶于水,且水溶液呈碱性.其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失,在常温条件下,饱和Li2CO3溶液中离子浓度由大到小的排列顺序为c(Li+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为2CO32--4e-=O2↑+CO2↑.

(1)金属M为Cu,操作1为过滤.
(2)加入H2O2的作用是(用离子方程式表示)2Fe2++H2O2+2H+=2Fe3++2H2O,加入氨水的作用是调节PH使Fe3+全部转化为氢氧化铁沉淀.
(3)由CoC2O4•2H2O转化为Co2 O3的化学方程式是4(CoC2O4?2H2O)+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8H2O+8CO2.
(4)知Li2CO3微溶于水,且水溶液呈碱性.其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失,在常温条件下,饱和Li2CO3溶液中离子浓度由大到小的排列顺序为c(Li+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
10.硫酸铜、硝酸铁都是重要的化工原料.
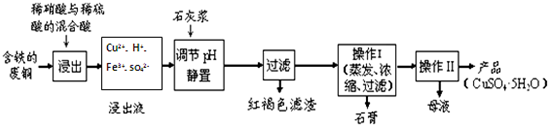
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
请回答下列问题:
①红褐色滤渣的主要成分是Fe(OH)3;
②写出浸出过程中生成硝酸铜的化学方程式3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
③操作I的温度应该控制在100℃左右;
④从溶液中分离出硫酸铜晶体的操作II应为将热溶液冷却结晶、过滤、洗涤、干燥.
(2)某兴趣小组在实验室利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行Fe(NO3)3对H2O2分解速率影响的实验.5min后可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是Fe(NO3)3在H2O2分解反应中起催化作用.从图a知H2O2的分解反应为放热反应,从图b也知2NO2?N2O4反应为放热反应,B瓶中H2O2在Fe(NO3)3催化剂的作用下分解快,相同时间内放热多,因此B瓶所处温度高,2NO2?N2O4平衡逆向移动,NO2浓度大,颜色深.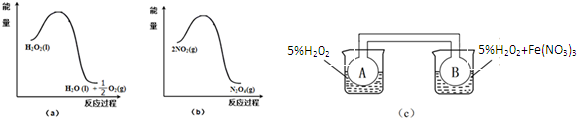
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图:

胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
①红褐色滤渣的主要成分是Fe(OH)3;
②写出浸出过程中生成硝酸铜的化学方程式3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
③操作I的温度应该控制在100℃左右;
④从溶液中分离出硫酸铜晶体的操作II应为将热溶液冷却结晶、过滤、洗涤、干燥.
(2)某兴趣小组在实验室利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行Fe(NO3)3对H2O2分解速率影响的实验.5min后可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是Fe(NO3)3在H2O2分解反应中起催化作用.从图a知H2O2的分解反应为放热反应,从图b也知2NO2?N2O4反应为放热反应,B瓶中H2O2在Fe(NO3)3催化剂的作用下分解快,相同时间内放热多,因此B瓶所处温度高,2NO2?N2O4平衡逆向移动,NO2浓度大,颜色深.

9.硼泥主要由MgO和SiO2组成,含有少量Fe2O3、FeO、Al2O3等杂质.用硼泥生产氢氧化镁的工艺流程如图所示:

已知某些氢氧化物沉淀的pH如下表所示:
(1)MgO的电子式为 .
.
(2)滤渣2的主要成分是Fe(OH)3、Al(OH)3,向滤渣2中继续加入过量的NaOH溶液,发生反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
(3)加入NaOH调节溶液pH=12.0时,发生反应的离子方程式为Mg2++2OH-═Mg(OH)2↓.
(4)利用Mg(OH)2与含SO2的烟气反应生成MgSO4,可以使烟气脱硫,该反应的化学方程式为2Mg(OH)2+2SO2+O2═2MgSO4+2H2O.
(5)若取a吨硼泥为原料,最后得到b吨Mg(OH)产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为$\frac{20b}{29a}$(用含有a、b的代数式表示).
0 167178 167186 167192 167196 167202 167204 167208 167214 167216 167222 167228 167232 167234 167238 167244 167246 167252 167256 167258 167262 167264 167268 167270 167272 167273 167274 167276 167277 167278 167280 167282 167286 167288 167292 167294 167298 167304 167306 167312 167316 167318 167322 167328 167334 167336 167342 167346 167348 167354 167358 167364 167372 203614

已知某些氢氧化物沉淀的pH如下表所示:
| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 Al(OH)3 | 2.7 3.7 | 3.7 4.7 |
 .
.(2)滤渣2的主要成分是Fe(OH)3、Al(OH)3,向滤渣2中继续加入过量的NaOH溶液,发生反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
(3)加入NaOH调节溶液pH=12.0时,发生反应的离子方程式为Mg2++2OH-═Mg(OH)2↓.
(4)利用Mg(OH)2与含SO2的烟气反应生成MgSO4,可以使烟气脱硫,该反应的化学方程式为2Mg(OH)2+2SO2+O2═2MgSO4+2H2O.
(5)若取a吨硼泥为原料,最后得到b吨Mg(OH)产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为$\frac{20b}{29a}$(用含有a、b的代数式表示).
