题目内容
17.一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )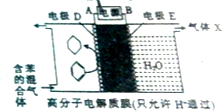
| A. | 电极D的电极反应式为C6H6+6H++6e-=C6H12 | |
| B. | 气体X在反应中通常体现还原性 | |
| C. | 电极D为惰性电极,E为活泼电极 | |
| D. | 外电路电子的移动方向:A→电源→B |
分析 根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是负极、B是正极,电子从负极流向阴极.
A、根据图知,D作阴极,发生苯得电子的还原反应;
B、根据图知,E作阳极,发生水失电子的氧化反应;
C、根据图知,电极D和E都没有参与反应,所以都为惰性电极;
D、根据以上分析,A是负极、B是正极,所以外电路电子的移动方向,B→电源→A;
解答 解:根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是负极、B是正极,电子从负极流向阴极,
A、根据图知,D作阴极,发生反应为苯中的碳得电子生成环己烷,反应式为C6H6+6H++6e-=C6H12,故A正确;
B、E作阳极,水失电子生成气体X为氧气,氧气体现氧化性,故B错误;
C、根据图知,电极D和E都没有参与反应,所以都为惰性电极,故C错误;
D、根据以上分析,A是负极、B是正极,所以外电路电子的移动方向,B→电源→A,故D错误;
故选:A.
点评 本题考查了电解池的反应原理,明确D作阴极,E作阳极,是解答的关键,题目难度中等.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
7.构成物质的聚集状态有固、液、气三种状态,科学研究表明,除了上述三种状态之外,还存在一些其它聚集状态,下列物质的状态属于其它聚集状态的是( )
①非晶体;②液晶;③纳米材料;④等离子体.
①非晶体;②液晶;③纳米材料;④等离子体.
| A. | ① | B. | ①② | C. | ①②③ | D. | ①②③④ |
8.313K时,水的Kw=3.0×10-14,则在313K时,c(H+)=10-7 mol/L的溶液( )
| A. | 呈酸性 | B. | 呈中性 | C. | 呈碱性 | D. | 无法判断 |
5.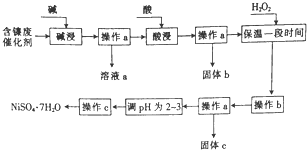 某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O,已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O,已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
部分阳离子以氢氧化物形式沉淀时的pH如下:
(1)操作a的名称是过滤.
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(4)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝.聚合氯化铝是一种新型净水剂,其中铝主要以[AlO4Al12(OH)2(H2O)12]2+(用Alb表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)22]2+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.
 某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O,已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O,已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| FE(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(4)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝.聚合氯化铝是一种新型净水剂,其中铝主要以[AlO4Al12(OH)2(H2O)12]2+(用Alb表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)22]2+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.
12.关于实现下列物品用途的主要物质的说法,不正确的是( )
| A. | 硫酸是铅蓄电池的电解质溶液,铅蓄电池可实现化学能转变成电能 | |
| B. | 硅酸干凝胶是硅酸干燥剂的主要成分,作用是吸收水分 | |
| C. | 肥皂的主要成分是硬脂酸钠,可以用于除去油污 | |
| D. | 二氧化硅是光能转化为电能的转化材料 |
6.金属材料是使用最广泛的一种材料,从古代到现代,金属材料经历了几次较大的变革.请回答下列问题:
(1)下面表格中的数据(铁和铜的某些物理数据)摘自某化学手册.
由表可推知,人类最早使用的金属材料是铜,请写出判断的理由:铜的熔点低于铁的熔点.
(2)考古中出土的青铜器、铁剑等往往锈迹斑斑.请完成下面铜、铁制品在自然条件下发生锈蚀的化学方程式:
①□Cu+□O2+□H2O+□CO2═□Cu2(OH)2CO3
②□Fe+□O2+□H2O═□Fe2O3•nH2O
(3)镁、铝是现代人常用的金属材料,这些活泼金属的冶炼方法是电解法,工业生产中,镁的冶炼采用的反应物是熔融氯化镁(或MgCl2),铝的冶炼采用的反应物是熔融氧化铝(或Al2O3).
(1)下面表格中的数据(铁和铜的某些物理数据)摘自某化学手册.
| 金属 | 颜色 | 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 比热[KJ/kg•℃] |
| Fe | 银白色 | 7.86 | 1 535 | 2 750 | 0.44 |
| Cu | 红色 | 8.92 | 1 083 | 2 567 | 0.38 |
(2)考古中出土的青铜器、铁剑等往往锈迹斑斑.请完成下面铜、铁制品在自然条件下发生锈蚀的化学方程式:
①□Cu+□O2+□H2O+□CO2═□Cu2(OH)2CO3
②□Fe+□O2+□H2O═□Fe2O3•nH2O
(3)镁、铝是现代人常用的金属材料,这些活泼金属的冶炼方法是电解法,工业生产中,镁的冶炼采用的反应物是熔融氯化镁(或MgCl2),铝的冶炼采用的反应物是熔融氧化铝(或Al2O3).
3.常见的离子晶体类型有多种,如图是其中一种空间构型,则该晶体中X、Y的离子个数之比可能为( )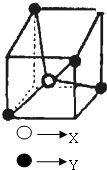

| A. | YX4 | B. | YX2 | C. | YX | D. | XY4 |
4.据报道,1995年我国科研人员在兰州首次合成了镤元素的一种同位素镤-239,并测知其原子核内有148个中子.现有A元素的一种同位素,比镤-239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是( )
| A. | 第5周期第IA族 | B. | 第4周期第IA族 | C. | 第3周期第IA族 | D. | 第3周期第IA族 |