题目内容
14.以下实验装置正确,且能达到实验目的是( )| A. | 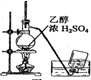 制备乙烯 | B. | 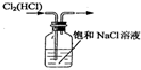 除去Cl2中的HCl | ||
| C. | 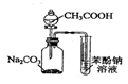 证明酸性:CH3COOH>H2CO3>苯酚 | D. | 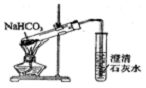 探究NaHCO3的热稳定性 |
分析 A.测定反应液的温度为170℃制备乙烯;
B.HCl极易溶于水,食盐水抑制氯气的溶解;
C.醋酸易挥发,醋酸与苯酚钠反应;
D.碳酸氢钠加热生成水,生成的水易倒流.
解答 解:A.测定反应液的温度为170℃制备乙烯,图中温度计的位置不合理,水银球应在液面以下,故A错误;
B.HCl极易溶于水,食盐水抑制氯气的溶解,则图中导管长进短出可除杂,故B正确;
C.醋酸易挥发,醋酸与苯酚钠反应,则图中不能比较碳酸、苯酚的酸性,故C错误;
D.碳酸氢钠加热生成水,生成的水易倒流,则图中加热的试管口应略向下倾斜,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的制备、混合物分离提纯、酸性比较及物质的性质等,把握物质的性质、反应原理及实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
4.短周期元素的原子,处于基态时可能具有的电子是( )
| A. | 只有s和p电子 | B. | 只有s电子 | C. | 只有p电子 | D. | 有s、p和d电子 |
5. 磷酸吡醛素是细胞的重要组成部分,可视为由磷酸形成的酯,其结构式如图,下列有关叙述不正确的是( )
磷酸吡醛素是细胞的重要组成部分,可视为由磷酸形成的酯,其结构式如图,下列有关叙述不正确的是( )
 磷酸吡醛素是细胞的重要组成部分,可视为由磷酸形成的酯,其结构式如图,下列有关叙述不正确的是( )
磷酸吡醛素是细胞的重要组成部分,可视为由磷酸形成的酯,其结构式如图,下列有关叙述不正确的是( )| A. | 该物质的分子式为C8H9O6NP | |
| B. | 该物质能与金属钠反应,能发生银镜反应,还能使石蕊试液变红 | |
| C. | 作为芳香族化合物,该物质可能具有芳香气味 | |
| D. | 1mol该酯与NaOH溶液反应,最多消耗3mol NaOH |
2.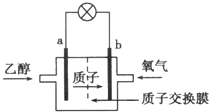 在2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇(CH3OH)电池效率高出32倍,且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图所示,下列说法中正确的是( )
在2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇(CH3OH)电池效率高出32倍,且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图所示,下列说法中正确的是( )
 在2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇(CH3OH)电池效率高出32倍,且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图所示,下列说法中正确的是( )
在2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇(CH3OH)电池效率高出32倍,且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图所示,下列说法中正确的是( )| A. | a极为电池的正极 | |
| B. | 电池工作时电子由b极沿导线经灯泡再到a极 | |
| C. | 电池正极的电极反应为:4H++O2+4e-=2H2O | |
| D. | 电池工作时,1 mol乙醇被氧化时就有6 mol电子转移 |
9.硼泥主要由MgO和SiO2组成,含有少量Fe2O3、FeO、Al2O3等杂质.用硼泥生产氢氧化镁的工艺流程如图所示:

已知某些氢氧化物沉淀的pH如下表所示:
(1)MgO的电子式为 .
.
(2)滤渣2的主要成分是Fe(OH)3、Al(OH)3,向滤渣2中继续加入过量的NaOH溶液,发生反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
(3)加入NaOH调节溶液pH=12.0时,发生反应的离子方程式为Mg2++2OH-═Mg(OH)2↓.
(4)利用Mg(OH)2与含SO2的烟气反应生成MgSO4,可以使烟气脱硫,该反应的化学方程式为2Mg(OH)2+2SO2+O2═2MgSO4+2H2O.
(5)若取a吨硼泥为原料,最后得到b吨Mg(OH)产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为$\frac{20b}{29a}$(用含有a、b的代数式表示).

已知某些氢氧化物沉淀的pH如下表所示:
| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 Al(OH)3 | 2.7 3.7 | 3.7 4.7 |
 .
.(2)滤渣2的主要成分是Fe(OH)3、Al(OH)3,向滤渣2中继续加入过量的NaOH溶液,发生反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
(3)加入NaOH调节溶液pH=12.0时,发生反应的离子方程式为Mg2++2OH-═Mg(OH)2↓.
(4)利用Mg(OH)2与含SO2的烟气反应生成MgSO4,可以使烟气脱硫,该反应的化学方程式为2Mg(OH)2+2SO2+O2═2MgSO4+2H2O.
(5)若取a吨硼泥为原料,最后得到b吨Mg(OH)产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为$\frac{20b}{29a}$(用含有a、b的代数式表示).
3. 某研究性学习小组对Zn跟一定量的浓硫酸反应生成的气体产物进行探究.
某研究性学习小组对Zn跟一定量的浓硫酸反应生成的气体产物进行探究.
【提出假设】:
小组同学经过分析讨论认为生成气体可能含H2和SO2.
【设计实验方案,验证假设】主要包括两个环节:
Ⅰ.验证SO2,实验装置如图所示;
Ⅱ.检验产物中含有H2,实验内容将由B部分导出的气体依次通过装置C、D、E、F、G.Ⅱ中装置C、D、E、F、G的信息如表所示:
试回答下列问题:
(1)小组同学认为生成气体中含H2的理由是随着反应的进行,硫酸的浓度变小;
(2)盛放锌粒的仪器名称是蒸馏烧瓶;
(3)B部分装置的目的是验证SO2并探究SO2与品红作用的可逆性,实验的操作及主要现象是品红溶液先褪色,加热后又恢复红色;
(4)①装置D、G的作用依次是干燥H2,防止干扰后面H2的检验、防止空气中的水蒸气进入H;
②E中发生反应的化学方程式是CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;
③试剂X是无水CuSO4粉末.
 某研究性学习小组对Zn跟一定量的浓硫酸反应生成的气体产物进行探究.
某研究性学习小组对Zn跟一定量的浓硫酸反应生成的气体产物进行探究.【提出假设】:
小组同学经过分析讨论认为生成气体可能含H2和SO2.
【设计实验方案,验证假设】主要包括两个环节:
Ⅰ.验证SO2,实验装置如图所示;
Ⅱ.检验产物中含有H2,实验内容将由B部分导出的气体依次通过装置C、D、E、F、G.Ⅱ中装置C、D、E、F、G的信息如表所示:
| 仪器标号 | C | D | E | F | G |
| 仪器 | 洗气瓶 | 洗气瓶 | 硬质玻璃管,加热 | 干燥管 | 干燥管 |
| 仪器中所加物质 | NaOH溶液 | 浓硫酸 | CuO粉末 | 试剂X | 无水CaCl2固体 |
(1)小组同学认为生成气体中含H2的理由是随着反应的进行,硫酸的浓度变小;
(2)盛放锌粒的仪器名称是蒸馏烧瓶;
(3)B部分装置的目的是验证SO2并探究SO2与品红作用的可逆性,实验的操作及主要现象是品红溶液先褪色,加热后又恢复红色;
(4)①装置D、G的作用依次是干燥H2,防止干扰后面H2的检验、防止空气中的水蒸气进入H;
②E中发生反应的化学方程式是CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;
③试剂X是无水CuSO4粉末.
20.一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
| A. | 以X浓度变化表示的反应速率为0.001 mol/(L•s) | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 其他条件不变时,若增大压强,则物质Y的转化率减小 | |
| D. | 其他条件不变时,若升高温度,X的体积分数增大,则该反应的△H>0 |
1.下列离子方程式正确的是( )
| A. | 铁与稀硝酸反应:Fe+2H+=Fe2++H2↑ | |
| B. | CuSO4与Ba (OH)2溶液混合 Cu2++SO42-+2OH-+Ba2+=BaSO4↓+Cu(OH)2↓ | |
| C. | 氯化钙与碳酸氢钾溶液混合:Ca2++CO32-=CaCO3↓ | |
| D. | 小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O |
