11.25℃时进行四组实验,其中“实验内容”与对应“现象或结论”关系错误的是( )
| 选项 | 实验内容 | 现象或结论 |
| A | 向2SO2+O2?2SO3的平衡体系中加入由18O构成的氧气 | 则SO2中的18O的含量会增加 |
| B | 向pH=1的盐酸和醋酸各0.5L的溶液中各加入1.4g铁粉 | 醋酸中生成H2的速率快且最终气体量多 |
| C | 以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉) | 阴极逸出气体且附近溶液渐呈红色 |
| D | 以Pb为负极,硫酸溶液为电解质的铅蓄电池,在放电过程中 | 负极质量增加,SO42-向负极迁移,溶液pH增大 |
| A. | A | B. | B | C. | C | D. | D |
10.下列离子方程式书写正确的是( )
| A. | 向KI与稀硫酸的混合溶液中通入氧气:4H++O2+6I-=3I2+2H2O | |
| B. | 亚硫酸钠溶液与双氧水混合:SO32-+2H2O2=SO42-+2H2O+O2↑ | |
| C. | a mol FeI2溶液中通入2a mol Cl2:2Fe2++4I-+3Cl2=2I2+2Fe3++6C1- | |
| D. | 硅酸钠溶液中通入过量的CO2:SiO32-+CO2+H2O=H2SiO3↓+CO32- |
9.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,1.12L1H2和0.2g 2H2均含有0.1NA个质子 | |
| B. | 在同压不同温的情况下,质量相同的氧气和臭氧所含氧原子数不相同 | |
| C. | 标准状况下,11.2L庚烷完全燃烧后生成的CO2分子数为3.5NA | |
| D. | 常温下,将5.6 g 铁投入足量的浓硫酸中转移电子数为0.3 NA |
8.将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺流程提取其他产品.
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是②③④(填序号).
①用混凝法获取淡水
②提高部分产品的质量
③优化提取产品的品种
④改进钾、溴、镁等的提取工艺
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收.已知该反应不产生CO2,且溴歧化为Br-和BrO3-,则反应的离子反应方程式为3Br2+6CO32-+3H2O=5Br-+BrO3-+6HCO3-.
(3)海水提镁的一段工艺流程如图:
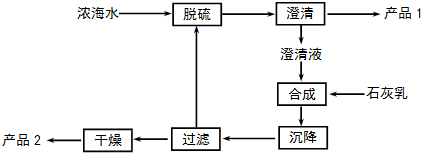
浓海水的主要成分如下:
该工艺过程中,脱硫阶段主要反应的阳离子Ca2+,沉降阶段反应的离子方程式为Mg2+(aq)+Ca(OH)2(s)=Mg(OH)2(s)+Ca2+(aq),浓海水的利用率为90%,则1L浓海水最多可得到产品2的质量为62.64g.
(4)由MgCl2•6H2O制备MgCl2固体时是在氯化氢气体氛围中加热进行,其目的是抑制MgCl2水解.
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是②③④(填序号).
①用混凝法获取淡水
②提高部分产品的质量
③优化提取产品的品种
④改进钾、溴、镁等的提取工艺
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收.已知该反应不产生CO2,且溴歧化为Br-和BrO3-,则反应的离子反应方程式为3Br2+6CO32-+3H2O=5Br-+BrO3-+6HCO3-.
(3)海水提镁的一段工艺流程如图:

浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
(4)由MgCl2•6H2O制备MgCl2固体时是在氯化氢气体氛围中加热进行,其目的是抑制MgCl2水解.
5.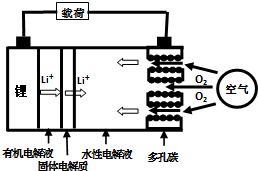 金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作示意图如下,下列说法正确的是( )
金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作示意图如下,下列说法正确的是( )
 金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作示意图如下,下列说法正确的是( )
金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作示意图如下,下列说法正确的是( )| A. | 放电时,空气极为负极 | |
| B. | 放电时,电池反应为:4Li+O2=2Li2O | |
| C. | 有机电解液可以是乙醇等无水有机物 | |
| D. | 在更换锂电极的同时,要更换水性电解液 |
4.短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与其他三种元素原子的内层电子数相同.X、Y均能与Z分别形成原子个数比为1:1、1:2的气态化合物.根据以上叙述,下列说法不正确的是( )
| A. | 上述气态化合物分子中所有原子最外层电子数均为8 | |
| B. | X、N、Z都可与W形成既有极性共价键又有非极性共价键的化合物 | |
| C. | 化合物W4XY2Z可能是离子化合物,也可能是共价化合物 | |
| D. | 沸点:W2Z>YW3>XW4 |
3.戊醇C5H11OH与下列物质发生反应时,所得产物可能结构种数最少(不考虑立体异构)的是( )
| A. | 与浓氢溴酸卤代 | B. | 与浓硫酸共热消去 | ||
| C. | 铜催化氧化 | D. | 与戊酸催化酯化 |
2.背景材料:
①浙大研制的石墨烯弹性气凝胶(又名碳海绵)入选2013年度世界最轻固体材料;
②2014年11月上旬北京APEC峰会期间,政府重拳整治雾霾,蓝天重现;
③中科大最近成功发现了一种新的铁基超导材料 (Li0.8Fe0.2)OHFeSe(Se呈-2价).
④瑞典皇家理工学院(KTH)的研究人员已经成功的构建出了一种能使水快速氧化成氧气的分子催化剂.
下列说法不正确的是( )
0 167027 167035 167041 167045 167051 167053 167057 167063 167065 167071 167077 167081 167083 167087 167093 167095 167101 167105 167107 167111 167113 167117 167119 167121 167122 167123 167125 167126 167127 167129 167131 167135 167137 167141 167143 167147 167153 167155 167161 167165 167167 167171 167177 167183 167185 167191 167195 167197 167203 167207 167213 167221 203614
①浙大研制的石墨烯弹性气凝胶(又名碳海绵)入选2013年度世界最轻固体材料;
②2014年11月上旬北京APEC峰会期间,政府重拳整治雾霾,蓝天重现;
③中科大最近成功发现了一种新的铁基超导材料 (Li0.8Fe0.2)OHFeSe(Se呈-2价).
④瑞典皇家理工学院(KTH)的研究人员已经成功的构建出了一种能使水快速氧化成氧气的分子催化剂.
下列说法不正确的是( )
| A. | 石墨烯弹性气凝胶可用作处理海上原油泄漏的吸油材料 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾的有效措施 | |
| C. | 新的铁基超导材料中Fe的化合价呈+2、+3价 | |
| D. | 该分子催化剂可将一次能源太阳能直接转化成二次能源 |