题目内容
6.工业上可以利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2?CH3OH+H2O.请回答下列问题: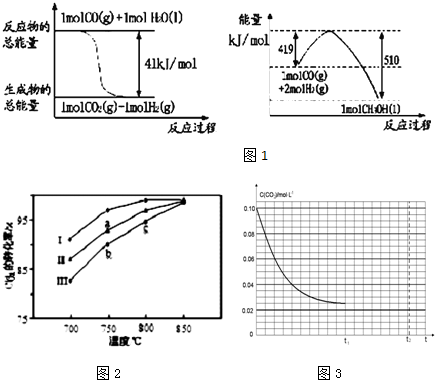
(1)已知常温常压下下列反应的能量变化如图1所示:写出由二氧化碳和氢气制备甲醇的热化学方程式CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol
(2)如果只改变一个条件使上述反应方程式的平衡常数K值变大,则该反应AD(选填编号).
A.一定向正反应方向移动
B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动
D.在平衡移动时逆反应速率先减小后增大
(3)其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图2所示.
①在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ.
②a点所代表的状态不是(填“是”或“不是”)平衡状态.
③c点CO2的转化率高于b点,原因是b、c点均未达到平衡状态,c点温度比b点高,反应速率较快,故CO2的转化率较大.
(4)若反应的容器容积为2.0L,反应时间4.0min,容器内气体的密度减少了2.0g/L,在这段时间内C02的平均反应速率为0.01mol.L-1.min-1.反应在t1时达到平衡,过程中c(CO2)随时间t变化趋势曲线右图所示.保持其他条件不变,t1时将容器体积压缩到1L,请在图3中画出t1后c(CO2)随时间t变化趋势曲线(假定t2时刻达到新的平衡).
分析 (1)根据图1中能量变化写出反应的热化学方程式为①CO(g)+H2O(l)=CO2(g)+H2(g)△H=-41kJ/mol,②CO(g)+2H2(g)=CH3OH(l)△H=-(510-419)kJ/mol=-91KJ/mol,根据盖斯定律进行计算,书写热化学方程式;
(2)平衡常数只受温度的影响,该反应为放热反应,平衡常数增大,则平衡向着正反应方向移动,说明降低了温度,据此进行解答;
(3)①由图象可知,该反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率为Ⅰ>Ⅱ>Ⅲ,依此判断催化剂的活性;
②催化剂只能改变反应速率,不能改变化学平衡;
③b、c点均未达到平衡状态,升高温度,化学反应速率加快,CO2的转化率较大;
(4)根据差量法计算出反应消耗的二氧化碳的物质的量,再根据v=$\frac{△c}{△t}$进行计算;根据压强对反应速率的影响画出t1后c(CO2)随时间t变化趋势曲线.
解答 解:(1)图1中的热化学方程式为①CO(g)+H2O(l)=CO2(g)+H2(g)△H=-41kJ/mol,
②CO(g)+2H2(g)=CH3OH(l)△H=-(510-419)kJ/mol=-91KJ/mol,
由②-①得:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol;
故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol;
(2)如果反应方程式CO2+3H2?CH3OH+H2O的平衡常数K值变大,则需要降低温度,
A.降低温度,平衡一定向正反应方向移动,故A正确;
B.降低温度后,正逆反应速率都减小,正反应速率在达到平衡前始终在减小,故B错误;
C.平衡常数变大,反应物浓度减小,生成物浓度增大,则化学平衡一定向正反应方向移动,故C错误;
D.化学平衡常数变大,需要降低温度,则正逆反应速率都减小,由于平衡向着正向移动,则逆反应速率先减小后增大,故D正确;
故答案为:AD;
(3)①由图象可知,该反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率为Ⅰ>Ⅱ>Ⅲ,所以三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是
Ⅰ>Ⅱ>Ⅲ,
故答案为:Ⅰ>Ⅱ>Ⅲ;
②催化剂只能改变反应速率,不能改变化学平衡,所以最终不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下达平衡时CO2的转化率相同,故a点所代表的状态不是平衡状态,
故答案为:不是;
③b、c点均未达到平衡状态,c点温度比b点高,反应速率较快,故CO2的转化率较大;
故答案为:b、c点均未达到平衡状态,c点温度比b点高,反应速率较快,故CO2的转化率较大;
(4)若反应的容器容积为2.0L,反应时间4.0min,容器内气体的密度减小了2.0g/L,则气体减小的质量为:2.0g/L×2.0L=4.0g,
CO2(g)+3H2(g)=CH3OH(l)+H2O(l) 气体减少质量△m
1mol 50
n 4.0g
反应消耗的二氧化碳的物质的量为:n=$\frac{1mol×4.0g}{50g}$=0.08mol,
在4min内C02的平均反应速率为:$\frac{\frac{0.08mol}{2L}}{4min}$=0.01mol.L-1.min-1;
保持其他条件不变,t1时将容器体积压缩到1L,t1时二氧化碳的浓度立刻增大为原先的2倍,即由0.025mol变为0.05mol,之后平衡向着正向移动,二氧化碳浓度减小,直至t2时达到新的平衡,t2时二氧化碳的浓度一定大于0.025mol,则t1后c(CO2)随时间t变化趋势曲线为 ,
,
故答案为:0.01mol.L-1.min-1; .
.
点评 本题考查盖斯定律的应用和热化学方程式的书写、化学反应速率的影响因素及相关计算、化学平衡移动原理等知识,题目难度较大.侧重学生的分析、理解能力及化学计算能力的培养.

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案| A. | 2种 | B. | 3种 | C. | 4种 | D. | 6种 |
 )是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )
)是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )| A. | 2种 | B. | 3 种 | C. | 4种 | D. | 5种 |
| A. | 2~3之间 | B. | 3~4之间 | C. | 4~5之间 | D. | 5~6之间 |
| 选项 | 实验内容 | 现象或结论 |
| A | 向2SO2+O2?2SO3的平衡体系中加入由18O构成的氧气 | 则SO2中的18O的含量会增加 |
| B | 向pH=1的盐酸和醋酸各0.5L的溶液中各加入1.4g铁粉 | 醋酸中生成H2的速率快且最终气体量多 |
| C | 以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉) | 阴极逸出气体且附近溶液渐呈红色 |
| D | 以Pb为负极,硫酸溶液为电解质的铅蓄电池,在放电过程中 | 负极质量增加,SO42-向负极迁移,溶液pH增大 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 丙烷的二卤代物是4种,则其六卤代物是2种 | |
| B. | 对二甲苯的核磁共振氢谱显示有3种化学环境的氢 | |
| C. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有3种 | |
| D. | 某烃的同分异构体只能形成一种一氯代物,其分子式可能为C5H12 |
| A. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+ )=c(NO3 - ) | |
| B. | 1.0 mol•L-1Na2CO3 溶液:c(OH-)=c(HCO3-)+c(H+) | |
| C. | pH=8.0的KHS溶液中,c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+) | |
| D. | 将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1NaOH溶液等体积混合后,溶液pH大于7,则反应后的混合液中:2c(OH-)+c (A-)=2c(H+)+c(HA) |
