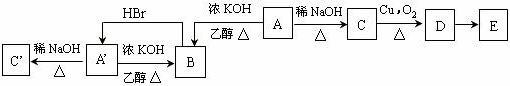
题目内容
11.25℃时进行四组实验,其中“实验内容”与对应“现象或结论”关系错误的是( )| 选项 | 实验内容 | 现象或结论 |
| A | 向2SO2+O2?2SO3的平衡体系中加入由18O构成的氧气 | 则SO2中的18O的含量会增加 |
| B | 向pH=1的盐酸和醋酸各0.5L的溶液中各加入1.4g铁粉 | 醋酸中生成H2的速率快且最终气体量多 |
| C | 以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉) | 阴极逸出气体且附近溶液渐呈红色 |
| D | 以Pb为负极,硫酸溶液为电解质的铅蓄电池,在放电过程中 | 负极质量增加,SO42-向负极迁移,溶液pH增大 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.2SO2+O2?2SO3为可逆反应;
B.pH=1的盐酸和醋酸各0.5L的溶液,醋酸的物质的量大于0.05mol,n(Fe)=0.025mol,则Fe与盐酸恰好反应,Fe与醋酸反应醋酸有剩余;
C.以石墨为电极,电解KI溶液,阴极上氢离子得到电子生成氢气;
D.电池反应为Pb+PbO2+2H2SO4 ═2PbSO4+2H2O,负极反应为Pb+SO42--2e-=PbSO4,阴离子向负极移动.
解答 解:A.2SO2+O2?2SO3为可逆反应,则平衡体系中加入由18O构成的氧气,三种物质均含18O,SO2中的18O的含量会增加,故A正确;
B.pH=1的盐酸和醋酸各0.5L的溶液,醋酸的物质的量大于0.05mol,n(Fe)=0.025mol,则Fe与盐酸恰好反应,Fe与醋酸反应醋酸有剩余,则醋酸中生成H2的速率快且最终气体相等,故B错误;
C.以石墨为电极,电解KI溶液,阴极上氢离子得到电子生成氢气,同时阴极得到氢氧根离子,则阴极逸出气体且附近溶液渐呈红色,故C正确;
D.负极反应为Pb+SO42--2e-=PbSO4,负极质量增加,阴离子向负极移动,由电池反应为Pb+PbO2+2H2SO4 ═2PbSO4+2H2O,可知消耗酸,则pH增大,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及化学平衡、pH计算及金属与酸反应、电化学原理等,把握反应原理及实验技能为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
相关题目
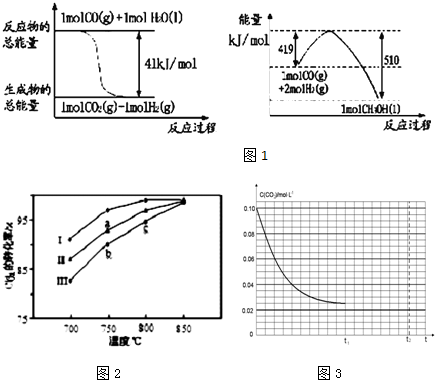
1.下列图示对应的叙述相符的是( )
| A. | 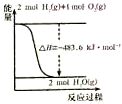 由图可知:H2的燃烧热为241.8kJ•mol-1 | |
| B. | 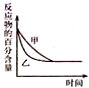 图中表示压强对反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙曲线对应的压强比甲的压强大 | |
| C. | 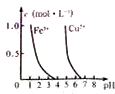 如图,若除去CuSO4溶液中的Fe2+,可向溶液中加入适量CuO,调节pH=4,过滤 | |
| D. | 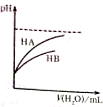 如图表示常温下HA、HB两种酸加水稀释时溶液pH的变化,则相同条件下,NaA溶液的pH大于NaB溶液的pH |
2.化学与生活密切相关,下列说法不正确的是( )
| A. | Na2O2可用作供氧剂 | |
| B. | 硅胶多孔,吸水能力强,常用作袋装食品的干燥剂 | |
| C. | SO2具有漂白性,常用药食品的漂白 | |
| D. | K2FeO4可用于水的净化 |
19.常温下,下列关于电解质溶液的说法正确的是( )
| A. | 将pH=4 CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 | |
| B. | 用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至pH=7,V(CH3COOH溶液)<V(NaOH溶液) | |
| C. | 向0.2 mol/L的盐酸溶液中加入等体积0.1 mol•L-1NH3•H2O溶液:c(Cl-)+c(OH-)=c(H+)+c(NH3•H2O) | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-) |
20.下列离子方程式正确的是( )
| A. | KI溶液中滴加稀硫酸:4H++4I-+O2=2I2+2H2O | |
| B. | 过量SO2通入氨水中:2NH3•H2O+SO2=2NH4++SO32-+H2O | |
| C. | NaAlO2溶液中滴加过量盐酸:AlO2-+H2O+H+=Al(OH)3↓ | |
| D. | 氨水滴入AgNO3溶液中至沉淀完全:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O |
1.下列装置能达到实验目的是( )
| A. |  如图所示装置完成实验室制氨气 | |
| B. | 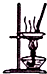 如图所示装置蒸发FeCl3溶液制备无水FeCl3 | |
| C. | 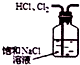 如图所示装置除去HCl中含有的少量Cl2 | |
| D. |  如图所示装置可用于分离二氧化锰和二氯化锰 |
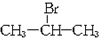 ;
;