题目内容
7.氮、磷及其化合物在科研及生产中均有着重要的应用.
(1)室温下,0.1mol/L的亚硝酸(HNO2)、次氯酸的电离常数Ka分别为:7.1×10-4,2.98×10-8.将0.1mol/L的亚硝酸稀释100倍,c(H+)将减小(填“不变”、“增大”、“减小”);Ka值将(填“不变”、“增大”、“减小”)不变.写出HNO2、HClO、NaNO2、NaClO四种物质之间发生的复分解反应的离子方程式HNO2+ClO2-=NO2-+HClO.
(2)羟胺(NH2OH) 可看成是氨分子内的l个氢原子被羟基取代的产物,常用作还原剂,其水溶液显弱碱性.已知NH2OH在水溶液中呈弱碱性的原理与NH3在水溶液中相似,请用电离方程式表示其原因NH2OH+H2O?[NH3OH]++OH-.
(3)亚硝酸钠与氯化钠都是白色粉末,且都有咸味,但亚硝酸盐都有毒性,通常它们可以通过加入热的白醋鉴别,亚硝酸钠遇到白醋会产生一种红棕色刺激性气味气体和一种无色刺激性气味气体,该反应的离子方程式为2NO2-+2CH3COOH═NO2+NO+2CH3COO-+H2O.
(4)磷及部分重要化合物的相互转化如图1所示.
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是做还原剂.
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为0.05mol.
(5)若处理后的废水中c(PO43-)=4×10-7 mol•L-1,溶液中c(Ca2+)=5×10-6mol•L-1.(已知Ksp[Ca3(PO4)2]=2×10-29)
(6)某液氨-液氧燃料电池示意图如图2,该燃料电池的工作效率为50%,现用作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液中NaOH的浓度为0.3mol•L-1,则该过程中消耗氨气的质量为1.7g.(假设溶液电解前后体积不变)
分析 (1)亚硝酸为弱电解质,亚硝酸稀释,电离程度虽然增大,但溶液中氢离子浓度降低;其电离常数只与温度有关;
由相同浓度亚硝酸、次氯酸电离常数可知,亚硝酸酸性比次氯酸强,根据强酸制备弱酸书写离子方程式;
(2)根据氨水呈弱碱性的原理分析羟胺呈弱碱性的原因;
(3)红棕色刺激性气味气体为NO2,无色刺激性气味气体为NO,据此书写离子反应液方程式即可;
(4)①依据发生反应2Ca3(PO4)2+6SiO2+10C→P4↑+6CaSiO3+10CO↑,判断CO的作用;
②依据氧化还原反应中铜元素、磷元素化合价变化计算;
(5)根据Ksp[Ca3(PO4)2]=[c(Ca2+)]3×c(PO43-)计算;
(6)电解过程中生成n(NaOH)=0.3mol/L×0.5L=0.15mol,设生成0.15molNaOH转移电子的物质的量为x,据此解答即可.
解答 解:(1)亚硝酸为弱电解质,亚硝酸稀释,电离程度虽然增大,但溶液中氢离子浓度降低;其电离常数只与温度有关,与浓度无关,Ki值不发生变化,由相同浓度亚硝酸、次氯酸电离常数可知,亚硫酸酸性比次氯酸强,可能相互之间发生的离子互换反应的离子方程式为:HNO2+ClO-=NO2-+HClO,
故答案为:减小;不变;HNO2+ClO-=NO2-+HClO;
(2)羟胺和水反应生成[NH3OH]+和OH-,导致溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性,故答案为:NH2OH+H2O?[NH3OH]++OH-;
(3)红棕色刺激性气味气体为NO2,无色刺激性气味气体为NO,离子反应方程式为:2NO2-+2CH3COOH═NO2+NO+2CH3COO-+H2O,
故答案为:2NO2-+2CH3COOH═NO2+NO+2CH3COO-+H2O;
(4)①步骤Ⅰ为白磷的工业生产方法之一,发生反应2Ca3(PO4)2+6SiO2+10C→P4↑+6CaSiO3+10CO↑,反应中C中的碳化合价升高,做还原剂,
故答案为:做还原剂;
②Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若有11molP4参加反应,其中5mol的P4做氧化剂,60mol硫酸铜做氧化剂,只有6mol的P4做还原剂,则由电子守恒可知,有1 mol的CuSO4参加反应,则被硫酸铜氧化的白磷分子的物质的量为n则:n×4(5-0)=1mol×(2-1),解得n=$\frac{1}{20}$mol=0.05mol,故答案为:0.05mol;
(5)若处理后的废水中c(PO43-)=4×10-7 mol•L-1,Ksp[Ca3(PO4)2]=[c(Ca2+)]3×c(PO43-)=2×10-29,c(Ca2+)=$\root{3}{\frac{2×1{0}^{-29}}{(4×1{0}^{-7})^{2}}}$=5×10-6mol•L-1,故答案为:5×10-6;
(6)电解过程中生成n(NaOH)=0.3mol/L×0.5L=0.15mol,设生成0.15molNaOH转移电子的物质的量为x,
2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑ 转移电子
2mol 2mol
0.15mol x
2mol:2mol=0.15mol:x,
x=0.15mol,串联电路中转移电子物质的量相等,且液氨-液氧燃料电池的效率为50%,则液氨失电子的物质的量为0.3mol,
设消耗氨气的质量为y,
4NH3+3O2=2N2+6H2O 转移电子
68g 12mol
y 0.3mol
68g:12mol=y:0.3mol,y=1.7g,故答案为:1.7g.
点评 本题综合考查的是难溶电解质的平衡、化学电源新型电池,以此为载体考查电池反应式的书写、方程式的有关计算,侧重考查分析、计算能力,明确串联电路中转移电子关系是解本题关键,题目难度不大.

| A. | 1mol甲苯含C-H键的数目为6NA | |
| B. | 反应5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O中生成28gN2时,转移电子数目为15NA | |
| C. | 1molFeCl3与水反应完全转化为氢氧化铁胶体后,胶体粒子的数目为NA | |
| D. | 含有4.6g钠元素的过氧化钠和氧化钠的混合物中,所含离子总数为0.3NA |
| A. | 乙烯可作为水果的催熟剂 | |
| B. | 地沟油经过处理,可用来制造肥皂 | |
| C. | 漂白粉长期暴露在空气中会变质失效 | |
| D. | 煤炭燃烧过程安装固硫装置,可有效提高煤的利用率 |
①浙大研制的石墨烯弹性气凝胶(又名碳海绵)入选2013年度世界最轻固体材料;
②2014年11月上旬北京APEC峰会期间,政府重拳整治雾霾,蓝天重现;
③中科大最近成功发现了一种新的铁基超导材料 (Li0.8Fe0.2)OHFeSe(Se呈-2价).
④瑞典皇家理工学院(KTH)的研究人员已经成功的构建出了一种能使水快速氧化成氧气的分子催化剂.
下列说法不正确的是( )
| A. | 石墨烯弹性气凝胶可用作处理海上原油泄漏的吸油材料 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾的有效措施 | |
| C. | 新的铁基超导材料中Fe的化合价呈+2、+3价 | |
| D. | 该分子催化剂可将一次能源太阳能直接转化成二次能源 |

| A. | 将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合后,溶液显碱性 | |
| B. | 如图可表示常温下,稀释HA、HB两种酸的稀溶液时溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 | |
| C. | 25℃时,pH=2的1.0 L 醋酸溶液中水电离出的H+的数目为10-12NA | |
| D. | 某吸热反应能自发进行,则该反应一定是熵增的反应 |

| A. | 放电时,电极A为负极 | |
| B. | 该电池工作的适宜温度应控制10℃左右 | |
| C. | 放电时,内电路中Na+的移动方向为A到B | |
| D. | 充电时,阳极的电极反应式为 Sx2--2e-═xS |
| A. | ⅣA族元素形成的氢化物的沸点从上到下依次递增,则ⅤA族元素所形成的氢化物的沸点从上到下也是依次递增 | |
| B. | 氯气可置换出KEr溶液中的溴,则氟气也可置换出KBr中的溴 | |
| C. | 某浓度的NaClO溶液的pH=d,则其中由水电离出的c(H+)=10-14+dmon•L-1 | |
| D. | 某温度下,MgCO3的Ksp=6.8×10-6,则该温度下所有含固体MgCO3的溶液,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.8×10-6 |
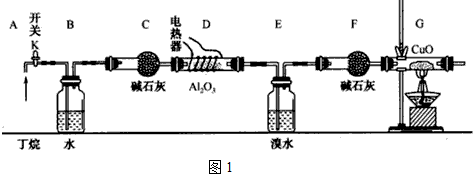
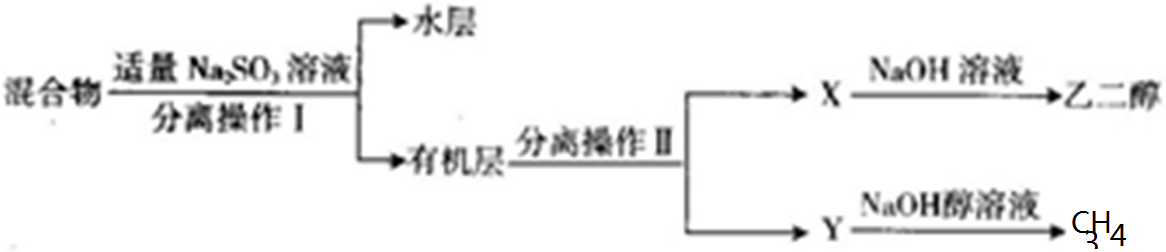
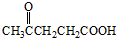 )合成聚芳酯E的路线:
)合成聚芳酯E的路线:
 +SOCl2→
+SOCl2→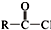 +SO2+HCl
+SO2+HCl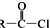 +R′OH→
+R′OH→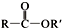 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基) .
. .
.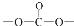 结构;
结构; .
.