题目内容
9.设NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 标准状况下,1.12L1H2和0.2g 2H2均含有0.1NA个质子 | |
| B. | 在同压不同温的情况下,质量相同的氧气和臭氧所含氧原子数不相同 | |
| C. | 标准状况下,11.2L庚烷完全燃烧后生成的CO2分子数为3.5NA | |
| D. | 常温下,将5.6 g 铁投入足量的浓硫酸中转移电子数为0.3 NA |
分析 A、1H2和2H2中含有的质子数都是2,标况下1.12L氢气的物质的量为0.05mol,含有0.1mol质子;
B、质量相同的氧气和臭氧,氧原子质量相同,结合n=$\frac{m}{M}$及N=nNA分析;
C、标准状况下,庚烷不是气体;
D、常温下铁在浓硫酸中发生钝化.
解答 解:A、标况下1.12L 1H2和0.2g 2H2的物质的量均为0.05mol,由于1H2和2H2中含有的质子数都是2,所以二者均含有0.1NA个质子,故A正确;
B、质量相同的氧气和臭氧,氧原子质量相同,由n=$\frac{m}{M}$可知,氧原子物质的量相同,则由N=nNA可知,原子个数相同,故B错误;
C、标准状况下,庚烷不是气体,11.2L庚烷物质的量不是0.5mol,故C错误
D、常温下铁在浓硫酸中发生钝化,不能继续反应,将5.6 g 铁投入足量的浓硫酸中转移电子数不是0.3 NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件的应用,物质的量计算微粒数,氧化还原反应电子转移计算,注意常温下铁在浓硫酸中钝化,题目较简单.

练习册系列答案
相关题目
19.短周期元素X、Y、Z、W,它们的原子序数依次增大.X与Z同主族,且原子序数之和为20.Y原子的质子数为Z原子的质子数的一半,W原子的最外层电子数比Y原子的最外层电子数多2个.下列叙述正确的是( )
| A. | 原子半径Z>W>Y>X | |
| B. | 气态氢化物的稳定性Z>W | |
| C. | Y的最高价氧化物对应的水化物可与其气态氢化物发生化合反应 | |
| D. | X的气态氢化物与足量W单质在光照条件下反应所得生成物均为气体 |
20.铝是我们很熟悉的一种金属元素,铊(Tl)和铝均位于元素周期表中的第ⅢA族,铊属于第三周期.则关于铊的下列性质中判断错误的是( )
| A. | 是银白色质软的金属 | B. | 能形成+3价的化合物 | ||
| C. | Tl(OH)3一定是两性氢氧化物 | D. | 单质铊的还原性一定比单质铝强 |
17.NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压,11.2 L NO和O2混合气体的原子数为NA | |
| B. | 1.5 g甲基所含有的电子数目为0.9NA | |
| C. | 1 L 0.1mol/L的氨水中含有的N原子数小于0.1NA | |
| D. | 7.8g苯中碳碳双键的数目为0.3NA |
4.短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与其他三种元素原子的内层电子数相同.X、Y均能与Z分别形成原子个数比为1:1、1:2的气态化合物.根据以上叙述,下列说法不正确的是( )
| A. | 上述气态化合物分子中所有原子最外层电子数均为8 | |
| B. | X、N、Z都可与W形成既有极性共价键又有非极性共价键的化合物 | |
| C. | 化合物W4XY2Z可能是离子化合物,也可能是共价化合物 | |
| D. | 沸点:W2Z>YW3>XW4 |
14.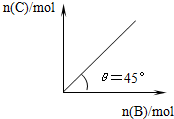 在盛有足量A的体积可变的密闭容器中,加入B,发生反应:
在盛有足量A的体积可变的密闭容器中,加入B,发生反应:
A(s)+2B(g)?4C(g)+D(g)△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变化关系如图.下列说法正确的是( )
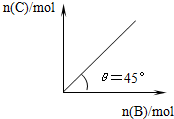 在盛有足量A的体积可变的密闭容器中,加入B,发生反应:
在盛有足量A的体积可变的密闭容器中,加入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变化关系如图.下列说法正确的是( )
| A. | 若保持压强一定,当温度升高后,则图中θ>45° | |
| B. | 若再加入B,则正、逆反应速率均逐渐增大 | |
| C. | 平衡时B的转化率为50% | |
| D. | 若保持压强一定,再加入B,则平衡后反应体系气体密度减小 |
1.分析下列各项结构的规律,按此规律排布第10项的分子式应为( )
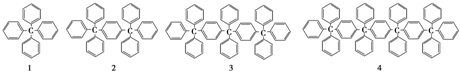

| A. | C198H146 | B. | C196H155 | C. | C196H146 | D. | C198H155 |
18.化学与生产、生活、社会密切相关,下列说法错误的是( )
| A. | 葡萄糖、麦芽糖均能与银氨溶液反应 | |
| B. | 甘氨酸和丙氨酸缩合最多可以形成四种二肽 | |
| C. | 富含蛋白质的豆浆煮沸后即可得人体所需的氨基酸 | |
| D. | 油酯在氢氧化钾溶液中水解可制得汽车洗涤用的液体肥皂 |
19.通过反应O2+PtF6=O2PtF6可以制得氧所形成的正价盐,经研究表明该化合物(O2PtF6)中存在阴离子PtF6-.下列说法正确的是( )
| A. | 该化合物含有离子键和共价键 | |
| B. | 1molO2参与该反应时,得到1mol电子 | |
| C. | 该化合物中阳离子与阴离子个数比为2:1 | |
| D. | O2PtF6的熔点可能比O2低 |