题目内容
2.背景材料:①浙大研制的石墨烯弹性气凝胶(又名碳海绵)入选2013年度世界最轻固体材料;
②2014年11月上旬北京APEC峰会期间,政府重拳整治雾霾,蓝天重现;
③中科大最近成功发现了一种新的铁基超导材料 (Li0.8Fe0.2)OHFeSe(Se呈-2价).
④瑞典皇家理工学院(KTH)的研究人员已经成功的构建出了一种能使水快速氧化成氧气的分子催化剂.
下列说法不正确的是( )
| A. | 石墨烯弹性气凝胶可用作处理海上原油泄漏的吸油材料 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾的有效措施 | |
| C. | 新的铁基超导材料中Fe的化合价呈+2、+3价 | |
| D. | 该分子催化剂可将一次能源太阳能直接转化成二次能源 |
分析 A.根据石墨烯具有疏松多孔的结构分析;
B.汽车尾气中含有烟尘等颗粒物,化石燃料的燃烧等都会产生大气的污染,调整产业结构,尽量减少对化石燃料的使用,能够减少雾霾;
C.根据(Li0.8Fe0.2)OHFeSe化合价代数和为0计算;
D.根据分子催化剂可以将水快速氧化成氧气分析.
解答 解:A.石墨烯具有疏松多孔的结构,所以具有很强的吸附性,则可用作处理海上原油泄漏的吸油材料,故A正确;
B.汽车尾气中含有燃料不充分燃烧产生的烟尘等,污染了空气,能引起大气中PM2.5增大,化石燃料燃烧会产生CO、SO2和粉尘等有害气体,污染了空气,能引起大气中PM2.5增大,产生雾霾天气,调整产业结构,尽量减少对化石燃料的使用,能够减少雾霾,故B正确;
C.因为(Li0.8Fe0.2)OHFeSe化合价代数和为0,又Li为+1价,O为-2价,H为+1价,Se为-2价,所以Fe的平均化合价为$\frac{2+2-1-0.8}{1.2}$=$\frac{11}{6}$,所以Fe的化合价不可能呈+2、+3价,故C错误;
D.因为分子催化剂可以将水快速氧化成氧气,所以该分子催化剂可将一次能源太阳能直接转化成二次能源,故D正确;
故选C.
点评 本题考查化学与生活、生产以及环境的有关知识,为高考高频考点,题目难度不大,了解信息并能获取信息是解答本题的关键,注意相关基础知识的积累.

练习册系列答案
相关题目
12.二氧化碳的过度排放会引发气候问题,而进行有效利用则会造福人类,如以CO2和NH3为原料合成尿素.经研究发现该反应过程为:
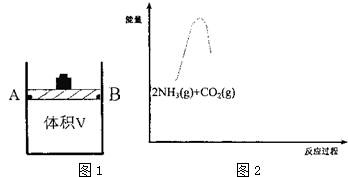
①C02(g)+2NH3(g)?NH2COONH4(s)△H1
②NH2COONH4(s)?CO(NH2)2(s)+H20(g)△H2>0 请回答下列问题:
(1)研究反应①的平衡常数(K)与温度(T)的关系,如图1所示,则△H1<. (选填“>”、“<”或).
(2)有体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如图2所示,现将3molNH3和2molC02放人 容器中,移动活塞至体积V为3L,用铆钉固定在A、B点,发生合成尿素的总反应如下:
C02(g)+2NH3(g)?CO(NH2)2(s)+H20(g)测定不同条件、不同时间段内的C02的转化率,得到如下数据:
①T1℃下,lOmin内NH3的平均反应速率为0.04mol•L-1•min-1.
②根据上表数据,请比较T1<T2(选填“>”、“<”或);T2℃下,第30min时,a150%,该温度下的化学平衡常数为9.
③T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动.再向容器中通入3molC02,此时v(正)= v(逆)(选填“>”、“<”或),判断的理由是T2℃下,通入3molC02,则容器体积变为原来的2倍,Qc=9=K,平衡不移动.
(3)请在图中2补画出合成氨总反应2NH3(g)+C02(g)?C0(NH2)2(s)+H2O(g)过程中能量变化图,并标明中间产物〔NH2COONH4(s)〕、生成物〔CO(NH2)2(s)+H20(g)〕.

①C02(g)+2NH3(g)?NH2COONH4(s)△H1
②NH2COONH4(s)?CO(NH2)2(s)+H20(g)△H2>0 请回答下列问题:
(1)研究反应①的平衡常数(K)与温度(T)的关系,如图1所示,则△H1<. (选填“>”、“<”或).
(2)有体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如图2所示,现将3molNH3和2molC02放人 容器中,移动活塞至体积V为3L,用铆钉固定在A、B点,发生合成尿素的总反应如下:
C02(g)+2NH3(g)?CO(NH2)2(s)+H20(g)测定不同条件、不同时间段内的C02的转化率,得到如下数据:
| CO2转化率 T(℃) | 10min | 20min | 30min | 40min |
| T1 | 30% | 65% | 75% | 75% |
| T | 45% | 50% | a1 | a2 |
②根据上表数据,请比较T1<T2(选填“>”、“<”或);T2℃下,第30min时,a150%,该温度下的化学平衡常数为9.
③T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动.再向容器中通入3molC02,此时v(正)= v(逆)(选填“>”、“<”或),判断的理由是T2℃下,通入3molC02,则容器体积变为原来的2倍,Qc=9=K,平衡不移动.
(3)请在图中2补画出合成氨总反应2NH3(g)+C02(g)?C0(NH2)2(s)+H2O(g)过程中能量变化图,并标明中间产物〔NH2COONH4(s)〕、生成物〔CO(NH2)2(s)+H20(g)〕.
13.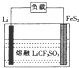 Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )
Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )
 Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )
Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )| A. | Li为电池的正极 | |
| B. | 电池工作时,Li+向负极移动 | |
| C. | 正极的电极反应式为FeS2+4e-=Fe+2S2- | |
| D. | 将熔融的LiCF2SO4改为LiCl的水溶液,电池能更好 |
10.为实现实验目的,其它主要仪器、试剂及需要在某个部位放置温度计合理的是( )
| 选项 | 实验目的 | 玻璃实验仪器 | 实验试剂 | 温度计位置 |
| A | 制取乙烯 | 圆底烧瓶、集气瓶、导气管、酒精灯 | 浓硫酸、乙醇 | 反应液中 |
| B | 提纯乙醇 | 蒸馏烧瓶、冷凝管、锥形瓶、承接管 | 75%的乙醇 | 支气管口 |
| C | 中和热测定 | 烧杯、环形玻璃搅拌棒 | 氢氧化钠、醋酸 | 酸、碱及反应液中 |
| D | 制银镜 | 烧杯、试管、酒精灯 | 银氨溶液、葡萄糖 | 水浴的烧杯水中 |
| A. | A | B. | B | C. | C | D. | D |
17.NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压,11.2 L NO和O2混合气体的原子数为NA | |
| B. | 1.5 g甲基所含有的电子数目为0.9NA | |
| C. | 1 L 0.1mol/L的氨水中含有的N原子数小于0.1NA | |
| D. | 7.8g苯中碳碳双键的数目为0.3NA |
14.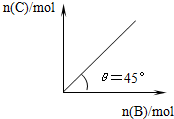 在盛有足量A的体积可变的密闭容器中,加入B,发生反应:
在盛有足量A的体积可变的密闭容器中,加入B,发生反应:
A(s)+2B(g)?4C(g)+D(g)△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变化关系如图.下列说法正确的是( )
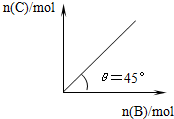 在盛有足量A的体积可变的密闭容器中,加入B,发生反应:
在盛有足量A的体积可变的密闭容器中,加入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变化关系如图.下列说法正确的是( )
| A. | 若保持压强一定,当温度升高后,则图中θ>45° | |
| B. | 若再加入B,则正、逆反应速率均逐渐增大 | |
| C. | 平衡时B的转化率为50% | |
| D. | 若保持压强一定,再加入B,则平衡后反应体系气体密度减小 |
11.化学与生活密切相关,下列说法不正确的是( )
| A. | 饮用牛奶和豆浆可以缓解重金属引起的中毒 | |
| B. | 向煤中加入适量石灰石,可减少其燃烧产物中的SO2,降低对大气的污染 | |
| C. | 食品包装袋、食物保鲜膜等材料的主要成分是聚氯乙烯 | |
| D. | 混凝法、中和法和沉淀法是污水处理中常用的化学方法 |
12.25℃时,溶液均为0.1mol/L的溶液,其pH如表所示,下列有关说法正确的是( )
| 序号 | ① | ② | ③ | ④ |
| 溶液 | NaCl | CH4COONH4 | NaF | NaHCO3 |
| pH | 7.0 | 7.0 | 8.1 | 8.4 |
| A. | 酸性强弱:H2CO3>HF | |
| B. | ①和②中溶质均未水解 | |
| C. | 离子的总浓度:①>③ | |
| D. | ④中:c(HCO3-)+2c(CO32-)+c(H2CO3)=0.1mol/L |
