题目内容
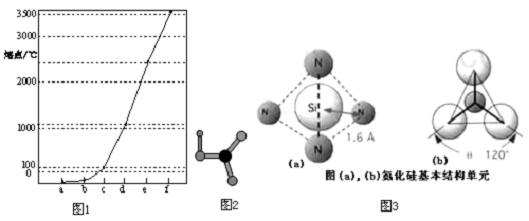
18. N、O、Na、Mg、S、Br是常见的六种元素.
N、O、Na、Mg、S、Br是常见的六种元素.(1)Br位于元素周期表第四周期第ⅦA族;基态Na+核外有10种运动状态不同的电子.Mg基态原子核外电子排布式为1s22s22p63s2.
(2)用“>”或“<”填空:
| 第一电离能 | 粒子半径 | 熔点 | 键的极性 |
| N>S | S2->Mg2+ | SO3<Na2O2 | H-O<H-N |
①放电时Na+向b极迁移(填“a或b”).
②充电时阴极电极反应式为:2S32-+2e-=3S22-.
(4)已知N4为正四面体结构,N-N键能为167kJ/mol,N≡N键能为942kJ/mol.写出N4(g)转化为N2(g)的热化学方程式N4(g)=2N2(g)△H=-882kJ/mol.
分析 (1)Br的原子序数为35,原子结构中有4个电子层,最外层电子数为7;Na的质子数为11,基态Na+核外有10个电子;Mg基态原子核外12个电子;
(2)非金属性越强,第一电离能越大;电子层越多,离子半径越大;离子晶体的熔点大于分子晶体的熔点;O的非金属性比N的强,则键的极性强;
(3)①原电池中,阳离子向正极移动;
②充电时阴极与电源负极相连,阴极得到电子发生还原反应;
(4)由信息可知N4(g)=2N2(g)△H=6×E(N-N)-2×E(N≡N),以此来解答.
解答 解:(1)Br的原子序数为35,原子结构中有4个电子层,最外层电子数为7,则位于第四周期ⅦA族;Na的质子数为11,基态Na+核外有10个电子,则有10种运动状态不同的电子;Mg基态原子核外12个电子,其基态原子核外电子排布式为1s22s22p63s2,
故答案为:四;ⅦA;10;1s22s22p63s2;
(2)非金属性N>S,第一电离能N>S;电子层越多,离子半径越大,则离子半径为S2->Mg2+;离子晶体的熔点大于分子晶体的熔点,则熔点为SO3<Na2O2;O的非金属性比N的强,则键的极性为H-O<H-N,故答案为:>;>;<;<;
(3)由电池反应可知,放电时,Br得到电子,S失去电子,则a为负极,b为正极,
①原电池中,阳离子向正极移动,则Na+向b移动,故答案为:b;
②充电时阴极与电源负极相连,阴极得到电子发生还原反应,阴极电极反应式为2S32-+2e-=3S22-,故答案为:2S32-+2e-=3S22-;
(4)由信息可知N4(g)=2N2(g)△H=6×E(N-N)-2×E(N≡N)=-882kJ/mol,则热化学方程式为N4(g)=2N2(g)△H=-882 kJ/mol,
故答案为:N4(g)=2N2(g)△H=-882 kJ/mol.
点评 本题考查较综合,为高频考点,涉及元素周期表的结构与性质、元素性质及元素化合物性质、原电池、热化学方程式等,侧重分析与应用能力的考查,综合性较强,题目难度不大.

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案(1)海水中含有许多化学物质,不能直接饮用,所以将海水转化为淡水是一项重大科研课题.电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示,
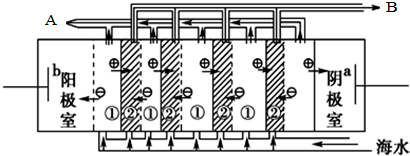 电渗析法淡化海水时阴极室可获得的重要化工原料有氢气、氢氧化钠.
电渗析法淡化海水时阴极室可获得的重要化工原料有氢气、氢氧化钠.(2)海水中含有大量的NaCl,盐田法仍是目前海水制盐的主要方法.盐田分为贮水池、蒸发池和结晶池,建盐田必须在BC处建立(填写序号).
A.选在离江河入海口比较近的地方B.多风少雨C.潮汐落差大且又平坦空旷的海滩
(3)盐田中所得为粗盐,若想用粗盐制烧碱,需对所用食盐水进行两次精制.第一次精制主要是用沉淀法除去粗盐水中的Ca2+、Mg2+、Fe3+、SO42-等离子,流程如下:
粗盐水$\stackrel{过量BaCl_{2}溶液}{→}$$\stackrel{过量Na_{2}CO_{3}溶液}{→}$$\stackrel{过量NaOH溶液}{→}$$\stackrel{过滤}{→}$滤液$→_{调pH}^{盐酸}$第一次精制食盐水
已知:20°C部分沉淀的溶解度(g)如下表:
| CaSO4 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
②运用表中数据解释过程I选用BaCl2而不选用CaCl2的原因BaSO4的溶解度比CaSO4的更小,可将SO42-沉淀的更完全.
(4)工业上通常以NaCl、CO2 和 NH3 为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl.
(5)工业制得的纯碱常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数.样品m克$→_{溶解}^{H_{2}O}$溶液$→_{过滤}^{过量BaCl_{2}溶液}$沉淀$→_{洗涤}^{H_{2}O}$$\stackrel{低温烘干、冷却、称量}{→}$固体n克
①检验沉淀是否洗涤干净的方法是取最后一次洗涤液于试管中,加入稀H2SO4溶液(或AgNO3(HNO3)溶液),若产生白色沉淀,则沉淀没有洗涤干净;若无白色沉淀,则沉淀已洗涤干净;
②样品中NaCl质量分数的数学表达式为(1-$\frac{106n}{197m}$)×100%.
| A. | 0.1 mol•L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 0.1 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=2c(CO32-)+c(HCO3-)+2c(H2CO3) | |
| C. | 0.1 mol•L-1NaHCO3溶液与0.2 mol•L-1NaOH溶液等体积混合:c(Na+)>c(OH-)>0.05 mol•L-1>c(CO32-)>c(HCO3-) | |
| D. | 0.2 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(CO32-)+c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
| A. | 向Ba(OH)2溶液中滴入硫酸溶液:Ba2++SO42-═BaSO4↓ | |
| B. | 向Na2CO3溶液中通入过量CO2气体:CO32-+CO2+H2O═2HCO3- | |
| C. | BaCO3溶于醋酸溶液:BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ |
| A. | 在溴富集过程中,可在分液漏斗中加入1mL溴水,再向其中加入3mL四氯化碳,振荡,静置,分液,得到下层液体 | |
| B. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 通常用产生气泡的快慢,比较不同条件下Na2S2O3溶液与稀硫酸反应速率 | |
| D. | 用pH计分别测定0.1mol/L的FeCl3和0.01mol/L的FeCl3的pH,可以比较浓度对盐类水解程度的影响 |
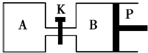 如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ/mol(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向容积相同的A、B容器中分别都充入2mol A2和1mol B2气体.两容器分别在500℃达平衡时,A中C的浓度为c1 mol/L,放出热量b kJ,B中C的浓度为c2 mol/L,放出热量c kJ.下列说法中正确的是( )
如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ/mol(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向容积相同的A、B容器中分别都充入2mol A2和1mol B2气体.两容器分别在500℃达平衡时,A中C的浓度为c1 mol/L,放出热量b kJ,B中C的浓度为c2 mol/L,放出热量c kJ.下列说法中正确的是( )| A. | 500℃达平衡时有:c1>c2 | |
| B. | 500℃达平衡时有:a>b>c | |
| C. | 达平衡后打开K,容器B的体积将减小 | |
| D. | 此反应的平衡常数随温度升高而增大 |
 镍及其化合物应用广泛
镍及其化合物应用广泛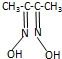 ) 常用于检验Ni:在一定条件下,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图1所示.
) 常用于检验Ni:在一定条件下,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图1所示.