题目内容
9.往含0.2mol NaOH和0.1mol Ba(OH)2的混合溶液中持续稳定地通入CO2气体6.72L(标准状况下),则在这一过程中,下列有关溶液中离子总物质的量(n)随通入CO2气体体积(V)的变化曲线中正确的是(离子水解忽略不计)( )| A. | 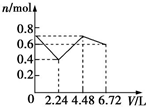 | B. | 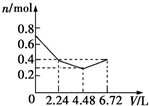 | C. | 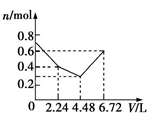 | D. | 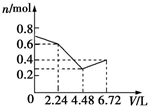 |
分析 n(CO2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,通入含有0.2mol氢氧化钠和0.1mol氢氧化钡的溶液中,发生:2OH-+CO2=CO32-+H2O,OH-+CO2=HCO3-+H2O,Ba2++CO32-=BaCO3↓,以此解答该题.
解答 解:n(CO2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,含有0.2mol氢氧化钠和0.1mol氢氧化钡的溶液中:n(OH-)=0.2mol+0.1mol×2=0.4mol,n(Na+)=0.2mol,
n(Ba2+)=0.1mol,
通入CO2,发生:2OH-+CO2=CO32-+H2O,OH-+CO2=HCO3-+H2O,Ba2++CO32-=BaCO3↓,
设生成xmolCO32-,ymolHCO3-,
则:2x+y=0.4
xx+y=0.3
解得x=0.1,y=0.2,
通入含有0.2molNaOH和0.1molBa(OH)2的溶液中,相当于首先发生:Ba2++2OH-+CO2=BaCO3↓,该阶段0.1molBa(OH)2完全反应消耗0.1molCO2,体积为2.24L,离子物质的量减少0.3mol,溶液中离子物质的量为0.7mol-0.3mol=0.4mol,其中含有0.2molOH-、生成0.1molBaCO3;
然后发生2OH-+CO2=CO32-+H2O,0.2molOH-完全反应消耗0.1molCO2,体积为2.24L,该阶段离子物质的量减少0.1mol,溶液中剩余离子物质的量为0.4mol-0.1mol=0.3mol,溶液中含有0.2molNa+、0.1molCO32-;
再发生CO32-+CO2+H2O=2HCO3-、BaCO3+CO2+H2O=Ba2++2HCO3-,消耗0.1molCO2,体积为2.24L,溶液中离子物质的量增大,溶液中离子为0.6mol,
所以图象C符合,
故选C.
点评 本题考查离子方程式的计算,题目难度中等,注意根据溶液中发生的反应结合各离子的物质的量计算分析,注意图象中各阶段离子的浓度变化.

| A. | SiO2(s)+2C(s)═Si(s)+2CO(g)只能在高温下自发进行,则该反应△H>0 | |
| B. | 电镀时,镀层金属跟直流电源的负极相连 | |
| C. | 锅炉内壁上沉积的CaSO4可先用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| D. | 向100 mL纯水中滴加1 mL浓硫酸,水的离子积常数Kw减小 |
| A. | 在0.1 mol•L-1NaOH溶液中:K+、Na+、SO42-、HCO3- | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:A13+、Na+、NO3-、C1- | |
| C. | 在0.1 mol•L-1FeCl3溶液中:K+、NH4+、I-、SCN- | |
| D. | 在$\frac{{c(H}^{+})}{{c(OH}^{-})}$=10-12的溶液中:K+、Na+、ClO-、NO3- |
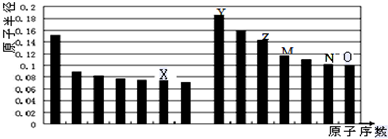
| A. | Y、O两种元素的离子半径相比,前者较大 | |
| B. | Z的氧化物能分别溶解于Y的最高氧化物的水化物和O的氢化物的水溶液 | |
| C. | 由X与Y两种元素组成的化合物只含离子键 | |
| D. | X、N两种元素的气态氢化物的稳定性相比,后者较强 |
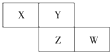 X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )
X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )| A. | X的气态氢化物比Y的稳定 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Z的非金属性比Y的弱 | |
| D. | X与Y形成的化合物都易溶于水 |
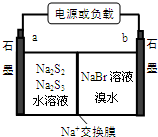 N、O、Na、Mg、S、Br是常见的六种元素.
N、O、Na、Mg、S、Br是常见的六种元素.(1)Br位于元素周期表第四周期第ⅦA族;基态Na+核外有10种运动状态不同的电子.Mg基态原子核外电子排布式为1s22s22p63s2.
(2)用“>”或“<”填空:
| 第一电离能 | 粒子半径 | 熔点 | 键的极性 |
| N>S | S2->Mg2+ | SO3<Na2O2 | H-O<H-N |
①放电时Na+向b极迁移(填“a或b”).
②充电时阴极电极反应式为:2S32-+2e-=3S22-.
(4)已知N4为正四面体结构,N-N键能为167kJ/mol,N≡N键能为942kJ/mol.写出N4(g)转化为N2(g)的热化学方程式N4(g)=2N2(g)△H=-882kJ/mol.
 已知甲、乙、丙、丁是中学化学常见的物质,一定条件下可发生如图转化:下列相关离子方程式或化学方程式错误的是( )
已知甲、乙、丙、丁是中学化学常见的物质,一定条件下可发生如图转化:下列相关离子方程式或化学方程式错误的是( )| A. | ①可能为CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | B. | ①可能为Fe+2Fe3+═3Fe2+ | ||
| C. | ②可能为2NO+O2═2NO2 | D. | ②可能为CO32-+H2O+CO2═2HCO3- |

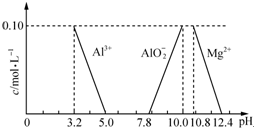 达喜[AlaMgb(OH)c(CO3)d•xH2O]常用于中和胃酸.
达喜[AlaMgb(OH)c(CO3)d•xH2O]常用于中和胃酸.