题目内容
8.海洋是地球上最广阔的水体的总称,其含水量约占地球上总水量的97%.(1)海水中含有许多化学物质,不能直接饮用,所以将海水转化为淡水是一项重大科研课题.电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示,
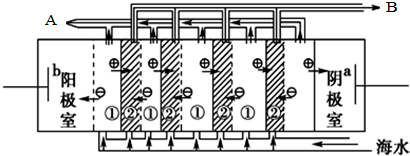 电渗析法淡化海水时阴极室可获得的重要化工原料有氢气、氢氧化钠.
电渗析法淡化海水时阴极室可获得的重要化工原料有氢气、氢氧化钠.(2)海水中含有大量的NaCl,盐田法仍是目前海水制盐的主要方法.盐田分为贮水池、蒸发池和结晶池,建盐田必须在BC处建立(填写序号).
A.选在离江河入海口比较近的地方B.多风少雨C.潮汐落差大且又平坦空旷的海滩
(3)盐田中所得为粗盐,若想用粗盐制烧碱,需对所用食盐水进行两次精制.第一次精制主要是用沉淀法除去粗盐水中的Ca2+、Mg2+、Fe3+、SO42-等离子,流程如下:
粗盐水$\stackrel{过量BaCl_{2}溶液}{→}$$\stackrel{过量Na_{2}CO_{3}溶液}{→}$$\stackrel{过量NaOH溶液}{→}$$\stackrel{过滤}{→}$滤液$→_{调pH}^{盐酸}$第一次精制食盐水
已知:20°C部分沉淀的溶解度(g)如下表:
| CaSO4 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
②运用表中数据解释过程I选用BaCl2而不选用CaCl2的原因BaSO4的溶解度比CaSO4的更小,可将SO42-沉淀的更完全.
(4)工业上通常以NaCl、CO2 和 NH3 为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl.
(5)工业制得的纯碱常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数.样品m克$→_{溶解}^{H_{2}O}$溶液$→_{过滤}^{过量BaCl_{2}溶液}$沉淀$→_{洗涤}^{H_{2}O}$$\stackrel{低温烘干、冷却、称量}{→}$固体n克
①检验沉淀是否洗涤干净的方法是取最后一次洗涤液于试管中,加入稀H2SO4溶液(或AgNO3(HNO3)溶液),若产生白色沉淀,则沉淀没有洗涤干净;若无白色沉淀,则沉淀已洗涤干净;
②样品中NaCl质量分数的数学表达式为(1-$\frac{106n}{197m}$)×100%.
分析 (1)在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,则水中的氢离子在阴极放电;
(2)海水晒盐需要浓缩、蒸发、结晶;建盐田必须在阳光充足、平坦空旷的地方;
(3)①检测Fe3+是否除尽,选择KSCN试剂观察是否出现血红色;
②过程I除去钡离子,由表格数据可知硫酸钡比碳酸钡更难溶;
(4)制取纯碱,第一步中NaCl、CO2 和 NH3 为原料反应生成碳酸氢钠和氯化铵;
(5)测定样品中NaCl的质量分数,由流程可知,固体ng为碳酸钡的质量,
①检验沉淀是否洗涤干净,可检验最后一次的洗涤液是否含钡离子或氯离子;
②由ngBaCO3~Na2CO3计算碳酸钠的质量,再计算NaCl质量分数.
解答 解:(1)在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,则水中的氢离子在阴极放电,则阴极生成氢气,同时生成NaOH,故答案为:氢气、氢氧化钠;
(2)海水晒盐需要浓缩、蒸发、结晶,则盐田分为贮水池、蒸发池和结晶池;建盐田必须在阳光充足、平坦空旷的地方,则选B.多风少雨、C.潮汐落差大且又平坦空旷的海滩,与A无关,故答案为:蒸发;BC;
(3)①检测Fe3+是否除尽的方法为取过程 III的滤液于试管中,向其中滴加KSCN溶液,若溶液不变色证明Fe3+已经沉淀干净,反之没除净,故答案为:取过程 III的滤液于试管中,向其中滴加KSCN溶液,若溶液不变色证明Fe3+已经沉淀干净,反之没除净;
②过程I除去钡离子,由表格数据可知硫酸钡比碳酸钡更难溶,则选用BaCl2而不选用CaCl2的原因为BaSO4的溶解度比CaSO4的更小,可将SO42-沉淀的更完全,故答案为:BaSO4的溶解度比CaSO4的更小,可将SO42-沉淀的更完全;
(4)制取纯碱,第一步中NaCl、CO2 和 NH3 为原料反应生成碳酸氢钠和氯化铵,该反应为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,故答案为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;
(5)测定样品中NaCl的质量分数,由流程可知,固体ng为碳酸钡的质量,
①检验沉淀是否洗涤干净的方法为取最后一次洗涤液于试管中,加入稀H2SO4溶液(或AgNO3(HNO3)溶液),若产生白色沉淀,则沉淀没有洗涤干净;若无白色沉淀,则沉淀已洗涤干净,故答案为:取最后一次洗涤液于试管中,加入稀H2SO4溶液(或AgNO3(HNO3)溶液),若产生白色沉淀,则沉淀没有洗涤干净;若无白色沉淀,则沉淀已洗涤干净;
②由BaCO3~Na2CO3可知碳酸钠的质量为$\frac{106n}{197}$g,则样品中NaCl质量分数为$\frac{m-\frac{106n}{197}}{m}$×100%=(1-$\frac{106n}{197m}$)×100%,故答案为:(1-$\frac{106n}{197m}$)×100%.
点评 本题考查较综合,涉及海水资源利用、含量测定及计算、混合物分离提纯等,侧重分析、推断、计算能力的综合考查,为高考中常见的考查方式,题目难度不大.

| A. | 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- | |
| D. | Fe3O4溶于足量浓盐酸:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| A. | K+、Al3+、NO3-、HCO3- | B. | H+、Na+、Fe2+、ClO- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | K+、NH4+、SO42-、OH- |
| A. | 4.6g 金属钠与足量乙醇反应放出2.24L氢气 | |
| B. | 50mL 18.4 mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| C. | 1mol羟基(-OH)中含电子数为10NA | |
| D. | 常温下,10L pH=12的Na2CO3溶液中含有的OH-离子数目为0.1NA |
| A. | 液氨汽化时吸收大量的热,可用作制冷剂 | |
| B. | 硅酸钠溶液呈碱性,可用作木材防火剂 | |
| C. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| D. | Fe比Cu活泼,可用FeCl3溶液腐蚀线路板上的Cu |
| A. | SiO2(s)+2C(s)═Si(s)+2CO(g)只能在高温下自发进行,则该反应△H>0 | |
| B. | 电镀时,镀层金属跟直流电源的负极相连 | |
| C. | 锅炉内壁上沉积的CaSO4可先用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| D. | 向100 mL纯水中滴加1 mL浓硫酸,水的离子积常数Kw减小 |
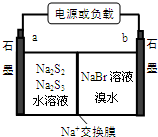 N、O、Na、Mg、S、Br是常见的六种元素.
N、O、Na、Mg、S、Br是常见的六种元素.(1)Br位于元素周期表第四周期第ⅦA族;基态Na+核外有10种运动状态不同的电子.Mg基态原子核外电子排布式为1s22s22p63s2.
(2)用“>”或“<”填空:
| 第一电离能 | 粒子半径 | 熔点 | 键的极性 |
| N>S | S2->Mg2+ | SO3<Na2O2 | H-O<H-N |
①放电时Na+向b极迁移(填“a或b”).
②充电时阴极电极反应式为:2S32-+2e-=3S22-.
(4)已知N4为正四面体结构,N-N键能为167kJ/mol,N≡N键能为942kJ/mol.写出N4(g)转化为N2(g)的热化学方程式N4(g)=2N2(g)△H=-882kJ/mol.

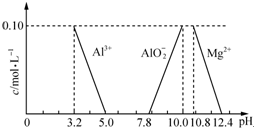 达喜[AlaMgb(OH)c(CO3)d•xH2O]常用于中和胃酸.
达喜[AlaMgb(OH)c(CO3)d•xH2O]常用于中和胃酸.