题目内容
3.下列离子方程式正确的是( )| A. | 向Ba(OH)2溶液中滴入硫酸溶液:Ba2++SO42-═BaSO4↓ | |
| B. | 向Na2CO3溶液中通入过量CO2气体:CO32-+CO2+H2O═2HCO3- | |
| C. | BaCO3溶于醋酸溶液:BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ |
分析 A.氢氧化钡与硫酸反应生成硫酸钡和水,漏掉了生成水的反应;
B.二氧化碳过量,反应生成碳酸氢根离子;
C.醋酸为弱酸,离子方程式中醋酸不能拆开;
D.根据电荷守恒判断,离子方程式两边负电荷不相等.
解答 解:A.氢氧化钡与硫酸反应生成难溶物硫酸钡和水,正确的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故A错误;
B.向Na2CO3溶液中通入过量CO2气体,反应生成碳酸氢钠,反应的离子方程式为:CO32-+CO2+H2O═2HCO3-,故B正确;
C.BaCO3溶于醋酸溶液,碳酸钡和醋酸都不能拆开,正确的离子方程式为:BaCO3+2CH3COOH=Ba2++H2O+CO2↑+2CH3COO-,故C错误;
D.铝溶于氢氧化钠溶液,反应生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2H2O+2OH-═2AlO2-+3H2↑,故D错误;
故选B.
点评 本题考查了离子方程式的正误判断,为高考中的高频题,属于中等难度的试题,注意掌握离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
13.下列物质性质与应用对应关系正确的是( )
| A. | 液氨汽化时吸收大量的热,可用作制冷剂 | |
| B. | 硅酸钠溶液呈碱性,可用作木材防火剂 | |
| C. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| D. | Fe比Cu活泼,可用FeCl3溶液腐蚀线路板上的Cu |
14.如图是部分短周期主族元素原子半径与原子序数的关系图.则下列说法正确的是( )
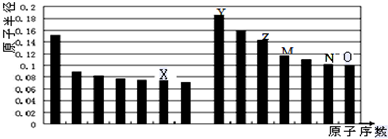

| A. | Y、O两种元素的离子半径相比,前者较大 | |
| B. | Z的氧化物能分别溶解于Y的最高氧化物的水化物和O的氢化物的水溶液 | |
| C. | 由X与Y两种元素组成的化合物只含离子键 | |
| D. | X、N两种元素的气态氢化物的稳定性相比,后者较强 |
11.某硝酸钠固体中混有少量硫酸铵和碳酸氢钠杂质,现设计一实验方案,既除去杂质,又配成硝酸钠溶液.实验方案:先将固体溶于蒸馏水配成溶液,选择合适的试剂和操作完成表格中各步实验.下列试剂或操作不合理的是( )
| 选择试剂 | ① | Na2CO3溶液 | ④ |
| 实验操作 | ② | ③ | 加热 |
| A. | 试剂①为Ba(OH)2溶液 | B. | 操作②为结晶 | ||
| C. | 操作③为过滤 | D. | 试剂④为稀HNO3 |
18.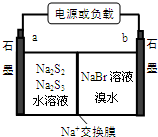 N、O、Na、Mg、S、Br是常见的六种元素.
N、O、Na、Mg、S、Br是常见的六种元素.
(1)Br位于元素周期表第四周期第ⅦA族;基态Na+核外有10种运动状态不同的电子.Mg基态原子核外电子排布式为1s22s22p63s2.
(2)用“>”或“<”填空:
(3)已知多硫化钠-溴储能电池是一种二次电池,结构如图.电池总反应为:2Na2S3+2NaBr?充电放电3Na2S2+Br2
①放电时Na+向b极迁移(填“a或b”).
②充电时阴极电极反应式为:2S32-+2e-=3S22-.
(4)已知N4为正四面体结构,N-N键能为167kJ/mol,N≡N键能为942kJ/mol.写出N4(g)转化为N2(g)的热化学方程式N4(g)=2N2(g)△H=-882kJ/mol.
 N、O、Na、Mg、S、Br是常见的六种元素.
N、O、Na、Mg、S、Br是常见的六种元素.(1)Br位于元素周期表第四周期第ⅦA族;基态Na+核外有10种运动状态不同的电子.Mg基态原子核外电子排布式为1s22s22p63s2.
(2)用“>”或“<”填空:
| 第一电离能 | 粒子半径 | 熔点 | 键的极性 |
| N>S | S2->Mg2+ | SO3<Na2O2 | H-O<H-N |
①放电时Na+向b极迁移(填“a或b”).
②充电时阴极电极反应式为:2S32-+2e-=3S22-.
(4)已知N4为正四面体结构,N-N键能为167kJ/mol,N≡N键能为942kJ/mol.写出N4(g)转化为N2(g)的热化学方程式N4(g)=2N2(g)△H=-882kJ/mol.
15.固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图.根据实验,以下说法正确的是
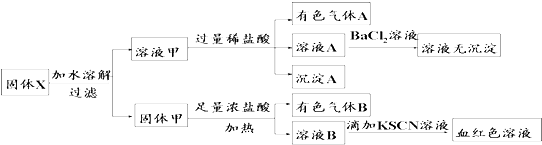
提示:a、HNO2是一种不稳定弱酸;b、在酸性条件下,NO2-可将SO32-氧化( )

提示:a、HNO2是一种不稳定弱酸;b、在酸性条件下,NO2-可将SO32-氧化( )
| A. | 溶液甲中一定含有K2SiO3、NaNO2、K2CO3,可能含有KAlO2 | |
| B. | 固体粉末X中可能含有K2SO3 | |
| C. | 气体A和气体B一定均为纯净物 | |
| D. | 原混合物中可能含有Fe2O3 |
12.现有部分短周期元素相关信息如下表所示:
(1)四种元素原子半径由大到小的顺序为Y>Z>X>T(用T、X、Y、Z表示).M中所含化学键的类型为离子键、共价键.
(2)若Z的单质及R在光伏电池产业、现代通讯产业中占据极为重要的位置,则R与M反应的离子方程式为SiO2+2OH-=SiO32-+H2O.若Z能形成稳定的单核离子,则请举例说明Z的金属性比Y的金属性弱:NaOH的碱性比Al(OH)3强.
(3)元素T与氢元素可形成原子个数比为1:1的化合物Q,元素X与氢元素可形成原子个数比为1:2的化合物W,W常用作发射火箭的燃料,Q与W按物质的量比为2:1的比例恰好反应生成X的单质和T的另一种氢化物,写出该反应的化学方程式2H2O2+N2H4=N2↑+4H2O.
| 元素 | T | X | Y | Z |
| 信息 | 原子最外层电子数比内层电子数多4 | 最高正价为+5,单质性质很稳定 | L层电子数比其他电子层电子数之和多5 | 单质、最高价氧化物(R)及对应的水化物均可与Y的最高价氧化物对应的水化物(M)反应 |
(2)若Z的单质及R在光伏电池产业、现代通讯产业中占据极为重要的位置,则R与M反应的离子方程式为SiO2+2OH-=SiO32-+H2O.若Z能形成稳定的单核离子,则请举例说明Z的金属性比Y的金属性弱:NaOH的碱性比Al(OH)3强.
(3)元素T与氢元素可形成原子个数比为1:1的化合物Q,元素X与氢元素可形成原子个数比为1:2的化合物W,W常用作发射火箭的燃料,Q与W按物质的量比为2:1的比例恰好反应生成X的单质和T的另一种氢化物,写出该反应的化学方程式2H2O2+N2H4=N2↑+4H2O.
13.某有机物的结构简式如图所示,有关该有机物的叙述不正确的是( )
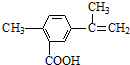

| A. | 在一定条件下,能发生取代、氧化、酯化和加聚反应 | |
| B. | 该物质分子中最多可以有9个碳原子在同一平面上 | |
| C. | 1 mol该物质最多可与4 mol H2发生加成反应 | |
| D. | 1 mol该物质完全氧化最多可消耗13 mol氧气 |
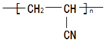 路线:
路线:
 .
.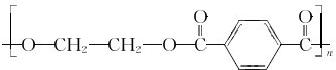 .
.