题目内容
6. 镍及其化合物应用广泛
镍及其化合物应用广泛(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸收涂层.试写出基态镍原子的核外电子排布式[Ar]3d84s2
(2)丁二酮肟 (
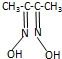 ) 常用于检验Ni:在一定条件下,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图1所示.
) 常用于检验Ni:在一定条件下,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图1所示.①该结构中,氮镍之间形成的化学键是配位键,从原子轨道重叠的方式看,碳氮之间的共价键类型为σ键π键
②该结构组成元素中C、N、O的第一电离能由小到大的顺序为C<O<N,碳原子的杂化类型有sp3、sp2
③该结构中,氧氮两元素之间除共价键外还可能存在氢键
(3)Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为-19.3℃.Ni(CO)4的晶体类型是分子晶体
请写出一种由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式

(4)金属镍与镧(La)形成合金是一种良好的诸氢配料,图2是一种镍镧合金储氢后的晶胞结构示意图,该合金储氢后,含1mol La的合金可吸附H2的数目为3×6.02×1023或3NA.
分析 (1)Ni是28号元素,其原子核外有28个电子,根据构造原理书写其基态原子核外电子排布式;
(2)①含有空轨道和含有孤电子对的原子之间易形成配位键;单键之间存在σ键,双键中一个是σ键一个是π键;
②同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;根据价层电子对互斥理论确定原子杂化方式;
③N、O原子电负性较强,能和氢原子形成氢键;
(3)分子晶体熔沸点较低;原子个数相等、价电子数相等的微粒互为等电子体;
(4)该晶胞中H2分子个数=8×$\frac{1}{4}$+2×$\frac{1}{2}$=3,La原子个数=8×$\frac{1}{8}$=1,根据La和氢气的关系式计算.
解答 解:(1)Ni是28号元素,其原子核外有28个电子,根据构造原理书写其基态原子核外电子排布式为[Ar]3d84s2,
故答案为:[Ar]3d84s2;
(2)①Ni原子含有空轨道、N原子含有孤电子对,所以二者形成配位键;C、N原子之间形成双键,所以含有σ键π键,
故答案为:配位键;σ键π键;
②同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,则第一电离能顺序为C<O<N,根据图知,C原子价层电子对个数有4个、3个,所以C原子采用sp3、sp2杂化,
故答案为:C<O<N;sp3、sp2;
③N、O原子电负性较强,所以该结构中,氧氮两元素之间除共价键外还可能存在氢键,故答案为:氢键;
(3)由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式为 ,
,
故答案为:分子晶体; ;
;
(4)该晶胞中H2分子个数=8×$\frac{1}{4}$+2×$\frac{1}{2}$=3,La原子个数=8×$\frac{1}{8}$=1,所以氢气分子和La原子个数之比为3:1,则含1mol La的合金可吸附H2的数目为3×6.02×1023或3NA,故答案为:3×6.02×1023或3NA.
点评 本题考查物质结构和性质,涉及晶胞计算、等电子体、晶体类型判断、氢键、核外电子排布、电离能等知识点,知道价层电子对互斥理论、构造原理、均摊法等即可解答,题目难度不大.

| A. | K+、Al3+、NO3-、HCO3- | B. | H+、Na+、Fe2+、ClO- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | K+、NH4+、SO42-、OH- |
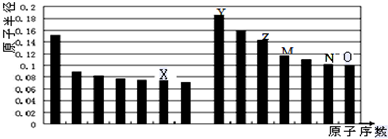
| A. | Y、O两种元素的离子半径相比,前者较大 | |
| B. | Z的氧化物能分别溶解于Y的最高氧化物的水化物和O的氢化物的水溶液 | |
| C. | 由X与Y两种元素组成的化合物只含离子键 | |
| D. | X、N两种元素的气态氢化物的稳定性相比,后者较强 |
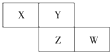 X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )
X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )| A. | X的气态氢化物比Y的稳定 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Z的非金属性比Y的弱 | |
| D. | X与Y形成的化合物都易溶于水 |
| 选择试剂 | ① | Na2CO3溶液 | ④ |
| 实验操作 | ② | ③ | 加热 |
| A. | 试剂①为Ba(OH)2溶液 | B. | 操作②为结晶 | ||
| C. | 操作③为过滤 | D. | 试剂④为稀HNO3 |
 N、O、Na、Mg、S、Br是常见的六种元素.
N、O、Na、Mg、S、Br是常见的六种元素.(1)Br位于元素周期表第四周期第ⅦA族;基态Na+核外有10种运动状态不同的电子.Mg基态原子核外电子排布式为1s22s22p63s2.
(2)用“>”或“<”填空:
| 第一电离能 | 粒子半径 | 熔点 | 键的极性 |
| N>S | S2->Mg2+ | SO3<Na2O2 | H-O<H-N |
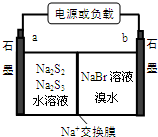
①放电时Na+向b极迁移(填“a或b”).
②充电时阴极电极反应式为:2S32-+2e-=3S22-.
(4)已知N4为正四面体结构,N-N键能为167kJ/mol,N≡N键能为942kJ/mol.写出N4(g)转化为N2(g)的热化学方程式N4(g)=2N2(g)△H=-882kJ/mol.
提示:a、HNO2是一种不稳定弱酸;b、在酸性条件下,NO2-可将SO32-氧化( )
| A. | 溶液甲中一定含有K2SiO3、NaNO2、K2CO3,可能含有KAlO2 | |
| B. | 固体粉末X中可能含有K2SO3 | |
| C. | 气体A和气体B一定均为纯净物 | |
| D. | 原混合物中可能含有Fe2O3 |
| A. |  移取醋酸 | B. | 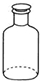 盛装NaOH溶液 | C. | 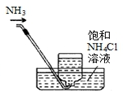 收集氨气 | D. | 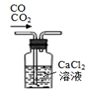 除去杂质CO2气体 |
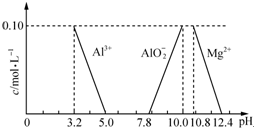 达喜[AlaMgb(OH)c(CO3)d•xH2O]常用于中和胃酸.
达喜[AlaMgb(OH)c(CO3)d•xH2O]常用于中和胃酸.