题目内容
7.如图1a~f分别表示由H、C、N、Na、Si、Cu元素组成的单质,其中c、d均为热和电的良导体.单质分别对应的熔点如图所示:
(1)从电负性角度分析,C、Si和N元素的非金属活泼性由强至弱的顺序为N>C>Si;
(2)图中d单质对应元素原子的电子排布式1s22s22p63s23p63d104s1.用价层电子对互斥理论推断,单质a、b、f对应的元素以原子个数比1:1:1形成的分子中化学键的键角为180°.
(3)a与b的元素形成的10电子中性分子X,X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成的含d元素离子的化学式为[Cu(NH3)4]2+.
(4)上述六种元素中的一种元素形成的含氧酸分子的结构模型(原子共平面)如图2:则可判断该元素原子(中心原子)的杂化方式是sp2杂化.氮化硅是一种高温陶瓷材料,硬度大、熔点高、化学性质稳定,其基本结构单元如图3,则其化学式为Si3N4.
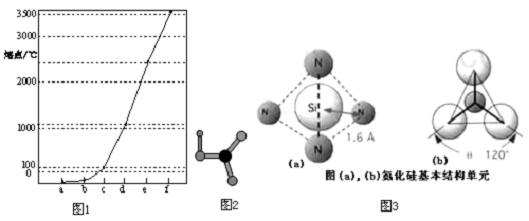
分析 单质氢气、氮气为气体,二者熔点低于其它固体单质,氢气的熔点最低,故a为H元素、b为N元素;碳、硅形成单质均可以形成原子晶体,熔点最高,而C-C键长小于Si-Si键长,故碳单质熔点高于硅,故f为C元素、e为Si元素;c、d均为热和电的良导体,为Na、Cu,而Cu的熔点高于Na,故c为Na、d为Cu.
(1)同周期自左而右非金属性增强、同主族自上而下非金属性减弱;
(2)d为Cu,是29号元素,根据核外电子排布规律书写其电子排布式;
H、N、C元素以原子个数比1:1:1形成的分子为HCN,计算C原子价层电子对数与孤电子对,确定其空间构型,进而确定键角;
(3)a与b的元素形成的10电子中性分子X为NH3,与铜离子形成四氨合铜络离子;
(4)图2为上述六种元素中的一种元素形成的含氧酸分子的结构模型,中心原子连接3个原子,由于原子共平面,所以中心原子没有孤电子对,中心原子采取sp2杂化;
由图可知,每个Si原子周围有4个N,每个N原子周围有3个Si原子,故Si、N原子数目之比为3:4.
解答 解:单质氢气、氮气为气体,二者熔点低于其它固体单质,氢气的熔点最低,故a为H元素、b为N元素;碳、硅形成单质均可以形成原子晶体,熔点最高,而C-C键长小于Si-Si键长,故碳单质熔点高于硅,故f为C元素、e为Si元素;c、d均为热和电的良导体,为Na、Cu,而Cu的熔点高于Na,故c为Na、d为Cu.
(1)同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故非金属性:N>C>Si,
故答案为:N>C>Si;
(2)d为Cu,是29号元素,原子的电子排布式为1s22s22p63s23p63d104s1;
H、N、C元素以原子个数比1:1:1形成的分子为HCN,C原子价层电子对数为2+$\frac{4-1-3}{2}$=2,没有孤电子对,其空间构型为直线型,故键角为180°,
故答案为:1s22s22p63s23p63d104s1;180°;
(3)a与b的元素形成的10电子中性分子X为NH3,与铜离子形成四氨合铜络离子,其化学式为[Cu(NH3)4]2+,
故答案为:[Cu(NH3)4]2+;
(4)图2为上述六种元素中的一种元素形成的含氧酸分子的结构模型,中心原子连接3个原子,由于原子共平面,所以中心原子没有孤电子对,中心原子采取sp2杂化;
由图可知,每个Si原子周围有4个N,每个N原子周围有3个Si原子,故Si、N原子数目之比为3:4,化学式为:Si3N4,
故答案为:sp2杂化;Si3N4.
点评 本题是对物质结构的考查,涉及晶体类型与性质、元素周期律、核外电子排布、杂化轨道、配合物、晶胞计算等,需要学生具备扎实的基础,难度中等.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案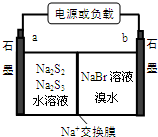 N、O、Na、Mg、S、Br是常见的六种元素.
N、O、Na、Mg、S、Br是常见的六种元素.(1)Br位于元素周期表第四周期第ⅦA族;基态Na+核外有10种运动状态不同的电子.Mg基态原子核外电子排布式为1s22s22p63s2.
(2)用“>”或“<”填空:
| 第一电离能 | 粒子半径 | 熔点 | 键的极性 |
| N>S | S2->Mg2+ | SO3<Na2O2 | H-O<H-N |
①放电时Na+向b极迁移(填“a或b”).
②充电时阴极电极反应式为:2S32-+2e-=3S22-.
(4)已知N4为正四面体结构,N-N键能为167kJ/mol,N≡N键能为942kJ/mol.写出N4(g)转化为N2(g)的热化学方程式N4(g)=2N2(g)△H=-882kJ/mol.
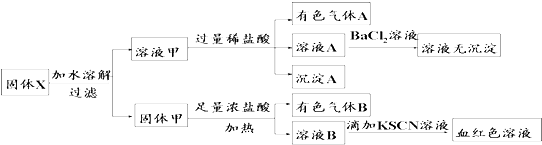
提示:a、HNO2是一种不稳定弱酸;b、在酸性条件下,NO2-可将SO32-氧化( )
| A. | 溶液甲中一定含有K2SiO3、NaNO2、K2CO3,可能含有KAlO2 | |
| B. | 固体粉末X中可能含有K2SO3 | |
| C. | 气体A和气体B一定均为纯净物 | |
| D. | 原混合物中可能含有Fe2O3 |
| A. | 等质量的铜分别与足量稀硝酸和浓硝酸充分反应,生成气体的物质的量相同 | |
| B. | 等质量的铁分别与足量氯气和硫充分反应,生成物质的物质的量相同 | |
| C. | 等质量的铝分别与足量氢氧化钠溶液和盐酸充分反应,生成气体的体积一定相同 | |
| D. | 等质量的氯气分别与足量氢氧化钠和硫化钠充分反应,转移的电子数相同 |
| 元素 | T | X | Y | Z |
| 信息 | 原子最外层电子数比内层电子数多4 | 最高正价为+5,单质性质很稳定 | L层电子数比其他电子层电子数之和多5 | 单质、最高价氧化物(R)及对应的水化物均可与Y的最高价氧化物对应的水化物(M)反应 |
(2)若Z的单质及R在光伏电池产业、现代通讯产业中占据极为重要的位置,则R与M反应的离子方程式为SiO2+2OH-=SiO32-+H2O.若Z能形成稳定的单核离子,则请举例说明Z的金属性比Y的金属性弱:NaOH的碱性比Al(OH)3强.
(3)元素T与氢元素可形成原子个数比为1:1的化合物Q,元素X与氢元素可形成原子个数比为1:2的化合物W,W常用作发射火箭的燃料,Q与W按物质的量比为2:1的比例恰好反应生成X的单质和T的另一种氢化物,写出该反应的化学方程式2H2O2+N2H4=N2↑+4H2O.
 已知甲、乙、丙、丁是中学化学常见的物质,一定条件下可发生如图转化:下列相关离子方程式或化学方程式错误的是( )
已知甲、乙、丙、丁是中学化学常见的物质,一定条件下可发生如图转化:下列相关离子方程式或化学方程式错误的是( )| A. | ①可能为CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | B. | ①可能为Fe+2Fe3+═3Fe2+ | ||
| C. | ②可能为2NO+O2═2NO2 | D. | ②可能为CO32-+H2O+CO2═2HCO3- |
| A. |  移取醋酸 | B. |  盛装NaOH溶液 | C. | 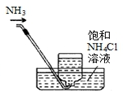 收集氨气 | D. | 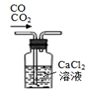 除去杂质CO2气体 |
| 容器 | 体积 | 起始物质 | 平衡时C的物质的量 | 平衡时B的体积分数 | 平衡常数 |
| 甲 | 1L | 1molA+2molB | 1mol | φ甲 | K甲 |
| 乙 | 1L | 4molC+2molD | n1 mol | φ乙 | K乙 |
| 丙 | 2L | 4molC+2molD | n2 mol | φ丙 | K丙 |
| A. | 在建立平衡的过程中,甲的Qc逐渐减小,乙和丙的Qc逐渐增大 | |
| B. | K甲=K丙>K乙 | |
| C. | 升高甲的温度,可使φ甲=φ乙 | |
| D. | n1=1.6,n2=2 |
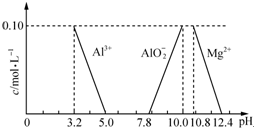 达喜[AlaMgb(OH)c(CO3)d•xH2O]常用于中和胃酸.
达喜[AlaMgb(OH)c(CO3)d•xH2O]常用于中和胃酸.