题目内容
13.下列溶液中有关物质的量浓度关系正确的是( )| A. | 0.1 mol•L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 0.1 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=2c(CO32-)+c(HCO3-)+2c(H2CO3) | |
| C. | 0.1 mol•L-1NaHCO3溶液与0.2 mol•L-1NaOH溶液等体积混合:c(Na+)>c(OH-)>0.05 mol•L-1>c(CO32-)>c(HCO3-) | |
| D. | 0.2 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(CO32-)+c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
分析 A.碳酸氢钠溶液中,碳酸根离子的水解程度大于其电离程度,溶液显示碱性,则c(CO32-)<c(H2CO3);
B.反应后溶液中溶质为碳酸钠,根据碳酸钠溶液中物料守恒判断;
C.反应后溶质为等浓度的碳酸钠和NaOH,钠离子浓度为0.15mol/L,氢氧根离子浓度大于0.05mol/L,据此判断溶液中各离子浓度大小;
D.反应后溶质为等浓度的碳酸钠和碳酸氢钠,结合混合液中的物料守恒、电荷守恒进行判断.
解答 解:A.0.1 mol•L-1NaHCO3溶液中,由于碳酸氢根离子的水解程度大于其电离程度,则:c(CO32-)<c(H2CO3),水解程度较小,则c(HCO3-)>c(CO32-),溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故A错误;
B.0.1 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合,二者恰好反应生成碳酸钠,根据碳酸钠溶液中的物料守恒可得:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故B错误;
C.0.1mol•L-1NaHCO3溶液与0.2 mol•L-1NaOH溶液等体积混合,反应后溶质为0.05mol/L的碳酸钠和氢氧化钠,钠离子浓度最大,氢氧根离子来自水的电离和氢氧化钠的电离,则c(OH-)>0.05 mol•L-1,则溶液中离子浓度大小为:c(Na+)>c(OH-)>0.05 mol•L-1>c(CO32-)>c(HCO3-),故C正确;
D.0.2 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合,反应后溶质为0.1mol•L-1Na2CO3、0.1mol•L-1NaHCO3,根据电荷守恒可得:①c(CO32-)+2c(OH-)+c(HCO3-)=c(H+)+c(Na+),根据物料守恒可得:②2c(Na+)=3c(CO32-)+3c(H2CO3+3c(HCO3-),根据①②可得:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+),故D错误;
故选C.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断等知识,题目难度中等,注意掌握盐的水解原理、酸碱混合的定性判断方法,能够根据电荷守恒、物料守恒、盐的水解原理判断溶液中各离子浓度大小.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 4.6g 金属钠与足量乙醇反应放出2.24L氢气 | |
| B. | 50mL 18.4 mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| C. | 1mol羟基(-OH)中含电子数为10NA | |
| D. | 常温下,10L pH=12的Na2CO3溶液中含有的OH-离子数目为0.1NA |
| A. | 在0.1 mol•L-1NaOH溶液中:K+、Na+、SO42-、HCO3- | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:A13+、Na+、NO3-、C1- | |
| C. | 在0.1 mol•L-1FeCl3溶液中:K+、NH4+、I-、SCN- | |
| D. | 在$\frac{{c(H}^{+})}{{c(OH}^{-})}$=10-12的溶液中:K+、Na+、ClO-、NO3- |
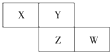 X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )
X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )| A. | X的气态氢化物比Y的稳定 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Z的非金属性比Y的弱 | |
| D. | X与Y形成的化合物都易溶于水 |
| A. | 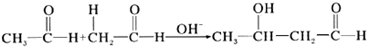 | |
| B. | CH2=CH-CH=CH2+2H2$→_{△}^{催化剂}$CH3-CH2-CH-CH3 | |
| C. | 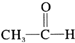 +H2$→_{△}^{催化剂}$CH3-CH-OH +H2$→_{△}^{催化剂}$CH3-CH-OH | |
| D. | CH3-CH2Br+NaOH$→_{△}^{H_{2}O}$CH3-CH2OH+NaBr |
 N、O、Na、Mg、S、Br是常见的六种元素.
N、O、Na、Mg、S、Br是常见的六种元素.(1)Br位于元素周期表第四周期第ⅦA族;基态Na+核外有10种运动状态不同的电子.Mg基态原子核外电子排布式为1s22s22p63s2.
(2)用“>”或“<”填空:
| 第一电离能 | 粒子半径 | 熔点 | 键的极性 |
| N>S | S2->Mg2+ | SO3<Na2O2 | H-O<H-N |
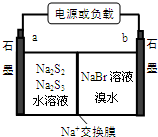
①放电时Na+向b极迁移(填“a或b”).
②充电时阴极电极反应式为:2S32-+2e-=3S22-.
(4)已知N4为正四面体结构,N-N键能为167kJ/mol,N≡N键能为942kJ/mol.写出N4(g)转化为N2(g)的热化学方程式N4(g)=2N2(g)△H=-882kJ/mol.
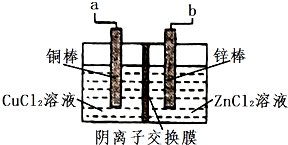 一种使用阴离子交换膜(只也许阴离子通过)的铜锌电池结构结构如图,如表选项两栏内容正确且相关联的是( )
一种使用阴离子交换膜(只也许阴离子通过)的铜锌电池结构结构如图,如表选项两栏内容正确且相关联的是( )| 选项 | 操作与现象 | 解释与推论 |
| A | 电池放电时化学能转化为电能 | Zn(s)+Cu2+(aq)=Zn2++Cu(s)△H>0 |
| B | 该电池充电时铜棒变细 | 两电极区溶液颜色都变深 |
| C | 该电池放电时铜棒是电池正极 | Cl-通过交换膜从左(铜棒区)向右(锌棒区)移动 |
| D | 该电池充电时a接电源正极 | 电极反应Cu2++2e-=Cu |
| A. | A | B. | B | C. | C | D. | D |
| A. | 等质量的铜分别与足量稀硝酸和浓硝酸充分反应,生成气体的物质的量相同 | |
| B. | 等质量的铁分别与足量氯气和硫充分反应,生成物质的物质的量相同 | |
| C. | 等质量的铝分别与足量氢氧化钠溶液和盐酸充分反应,生成气体的体积一定相同 | |
| D. | 等质量的氯气分别与足量氢氧化钠和硫化钠充分反应,转移的电子数相同 |
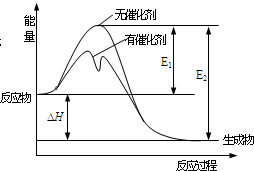 2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 该反应为吸热反应 | |
| B. | 升高温度,不影响活化分子百分数 | |
| C. | 使用催化剂使该反应的反应热发生改变 | |
| D. | E1-E2=△H |