题目内容
1.A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1.E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同.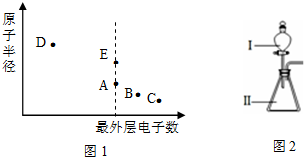
试回答:
(1)元素E在元素周期表中的位置是第三周期ⅣA族.
(2)与元素D离子所含电子数和质子数均相同的微粒是NH4+ (或H3O+).
(用化学式作答,下同)
(3)B和E最高价氧化物对应的水化物,酸性较弱的为H2SiO3.若用上图2中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:ⅠHNO3,ⅡNa2SiO3,观察到的实验现象是中出现白色胶状沉淀.
(4)由以上五种元素组成的中学常见的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A、C、D的盐 |
| b | C、D组成的化合物,且原子数之比为1:1 |
| c | 化学组成为AC2 |
②b与c反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2.
分析 A、B、C、D、E为原子序数依次增大的短周期主族元素,E原子最外层上的电子数是D原子最外层电子数的4倍,则D处于IA族,E处于ⅣA族,E与A最外层电子数相同,二者同周期,且E的原子半径较大,故A为碳元素、E为Si;最外层电子数C>B>4,且二者原子半径小于碳原子,故B、C处于第二周期,C利用形成离子C2-,故C为O元素,则B为N元素;D离子核外电子排布与O2-相同,且D处于IA族,故D为Na,(4)中由以上五种元素组成的中学常见物质,a是含有C、O、Na的盐,则a为Na2CO3,c的化学组成为AC2,则c为CO2,b是O、Na组成的化合物,且原子数之比为1:1,则b为Na2O2,据此解答.
解答 解:A、B、C、D、E为原子序数依次增大的短周期主族元素,E原子最外层上的电子数是D原子最外层电子数的4倍,则D处于IA族,E处于ⅣA族,E与A最外层电子数相同,二者同周期,且E的原子半径较大,故A为碳元素、E为Si;最外层电子数C>B>4,且二者原子半径小于碳原子,故B、C处于第二周期,C利用形成离子C2-,故C为O元素,则B为N元素;D离子核外电子排布与O2-相同,且D处于IA族,故D为Na.
(1)元素E为Si,在元素周期表中的位置是:第三周期ⅣA族,故答案为:第三周期ⅣA族;
(2)元素D离子为Na+,与Na+所含电子数和质子数均相同的微粒是:NH4+ (或H3O+),故答案为:NH4+ (或H3O+);
(3)B和E最高价氧化物对应的水化物分别为HNO3、H2SiO3,酸性较弱的为H2SiO3,若验证这两种酸的酸性强弱,根据强酸制弱酸的原理,则在装置中加入的试剂分别为:Ⅰ为HNO3,Ⅱ为Na2SiO3,发生反应:2HNO3+Na2SiO3=H2SiO3↓+2NaNO3,现象为:Ⅱ中出现白色胶状沉淀,
故答案为:HNO3;Na2SiO3;中出现白色胶状沉淀;
(4)由以上五种元素组成的中学常见物质,a是含有C、O、Na的盐,则a为Na2CO3,c的化学组成为AC2,则c为CO2,b是O、Na组成的化合物,且原子数之比为1:1,则b为Na2O2,
①a为Na2CO3,含有离子键、共价键,故答案为:离子键、共价键;
②b与c反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2.
点评 本题考查结构位置性质关系应用,推断元素是解题关键,注意理解掌握金属性、非金属性强弱比较实验事实.

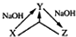 化学之“化”,体现在物质之间的相互转化,用X表示下列物质,其中在溶液中不可能实现如图转化关系的是( )
化学之“化”,体现在物质之间的相互转化,用X表示下列物质,其中在溶液中不可能实现如图转化关系的是( )| A. | AlCl3 | B. | CO2 | C. | SiO2 | D. | H2S |
| A. | C2H4 | B. | CaCl2 | C. | Na2O2 | D. | NH4NO3 |

| A. | 原子序数是15 | B. | 它是非金属元素 | ||
| C. | 磷原子最外层有5个电子 | D. | 磷元素在地壳中的含量为30.97% |
| A. | 少量二氧化硫与苛性钠溶液反应:SO2+2OH-=SO32-+H2O | |
| B. | 过量稀盐酸加入纯碱中:CO32-+2H+=H2O+CO2↑ | |
| C. | 铜粉与稀硫酸溶液反应:Cu+2H+=Cu2++H2↑ | |
| D. | 在氯化铝溶液中滴加过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
| A. | CH3CH2CH3分子中的3个碳原子不可能在同一直线上 | |
| B. | 油脂在酸性条件下的水解反应称为皂化反应 | |
| C. | 聚氯乙烯、麦芽糖和蛋白质均属于有机高分子化合物 | |
| D. | CH3CH2OH与CH3CO18OH发生酯化反应所得混合液中,18O原子只存在于水分子中 |
| A. | 丙酸甲酯 | B. | 已烷 | C. | 已烯 | D. | 二氯丁烷 |
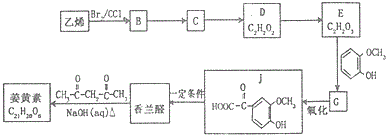

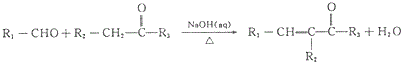 (R1、R2、R3为烃基或氢原子)
(R1、R2、R3为烃基或氢原子)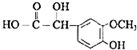 .经测定姜贡素的分子中有2个甲基,则香兰醛生成姜黄素的化学方程式为
.经测定姜贡素的分子中有2个甲基,则香兰醛生成姜黄素的化学方程式为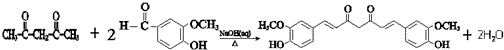 .
.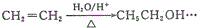
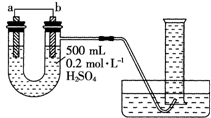 现用如图装置来测定原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题:
现用如图装置来测定原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题: