题目内容
9.元素周期表是化学学习的工具.如图是磷元素在周期表中的表示,下列有关磷元素的信息不正确的是( )
| A. | 原子序数是15 | B. | 它是非金属元素 | ||
| C. | 磷原子最外层有5个电子 | D. | 磷元素在地壳中的含量为30.97% |
分析 由“上图是磷元素在周期表中的表示”可知有关磷元素的信息:根据“原子序数=核内质子数=核外电子数=核电荷数”,可知原子序数;由磷的汉语名称,可知其元素种类;可推测原子结构示意图等信息,30.97是磷的相对原子质量,据此解答.
解答 解:A、由上图可知,原子序数为15,故A正确;
B、由磷的汉语名称,可知其元素种类为:非金属元素,故B正确;
C、根据“原子序数=核内质子数=核外电子数”,磷原子最外层有5个电子,故C正确;
D、30.97是磷的相对原子质量,而不是地壳中的含量,故D错误.
故选D.
点评 本题考查元素周期表的特点及其应用,比较基础,注意了解元素的简单分类和地壳中元素的发布与含量,了解原子结构示意图的特点.

练习册系列答案
相关题目
20.铁单质及其化合物在生活、生产中应用广泛.请回答:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为O2+2H2O+4e-=4OH-.
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+.
(3)若将(2)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式.
正极反应Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)
负极反应Cu=2Cu2++2e-(或Cu-2e-=Cu2+).
(4)下表中,对陈述I、Ⅱ的正确性及其有无因果关系的判断都正确的是B(填字母).
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为O2+2H2O+4e-=4OH-.
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+.
(3)若将(2)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式.
正极反应Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)
负极反应Cu=2Cu2++2e-(或Cu-2e-=Cu2+).
(4)下表中,对陈述I、Ⅱ的正确性及其有无因果关系的判断都正确的是B(填字母).
| 陈述I | 陈述Ⅱ | 判断 | |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | I对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁得到铁 | I对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁的某些化合物可用作催化剂 | I错;Ⅱ对;无 |
| D | 在空气中铁表面形成致密氧化膜 | 铁不能与氧气反应 | I对;Ⅱ对;有 |
17.下列变化或事实与范德华力无关的是( )
| A. | 气体物质加压或降温时能凝结或凝固 | |
| B. | 碘溶于四氯化碳 | |
| C. | 氟、氯、溴、碘单质的熔沸点依次升高 | |
| D. | 食盐熔化 |
14. X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置如图.下列说法正确的是( )
 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置如图.下列说法正确的是( )| A. | 五种元素中,原子半径最大的是W | |
| B. | Y的简单阴离子比W的简单阴离子还原性强 | |
| C. | Y与Z形成的化合物都可以和盐酸反应 | |
| D. | Q形成的含氧酸一定比W形成的含氧酸强 |
1.A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1.E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同.

试回答:
(1)元素E在元素周期表中的位置是第三周期ⅣA族.
(2)与元素D离子所含电子数和质子数均相同的微粒是NH4+ (或H3O+).
(用化学式作答,下同)
(3)B和E最高价氧化物对应的水化物,酸性较弱的为H2SiO3.若用上图2中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:ⅠHNO3,ⅡNa2SiO3,观察到的实验现象是中出现白色胶状沉淀.
(4)由以上五种元素组成的中学常见的物质,其组成和结构信息如下表:
①a含有的化学键有离子键、共价键;
②b与c反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2.

试回答:
(1)元素E在元素周期表中的位置是第三周期ⅣA族.
(2)与元素D离子所含电子数和质子数均相同的微粒是NH4+ (或H3O+).
(用化学式作答,下同)
(3)B和E最高价氧化物对应的水化物,酸性较弱的为H2SiO3.若用上图2中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:ⅠHNO3,ⅡNa2SiO3,观察到的实验现象是中出现白色胶状沉淀.
(4)由以上五种元素组成的中学常见的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A、C、D的盐 |
| b | C、D组成的化合物,且原子数之比为1:1 |
| c | 化学组成为AC2 |
②b与c反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2.
5.下列变化中,不需要破坏化学键的是( )
| A. | 加热碳酸氢钠 | B. | 氯化氢溶于水 | C. | 食盐熔化 | D. | 干冰气化 |
6.对于反应2SO2+O2$?_{加热}^{催化剂}$2SO3,下列判断正确的是( )
| A. | 2 mol SO2和足量的O2反应,可生成2 mol SO3 | |
| B. | 达到反应限度时SO2、O2、SO3的分子数之比一定为2:1:2 | |
| C. | 达到反应限度时SO2的消耗速率必定等于O2的生成速率的2倍 | |
| D. | 若反应在恒容容器中进行,气体密度保持不变,可以判定反应到达平衡 |
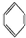 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.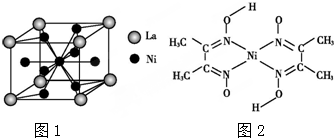
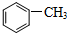 )中碳原子的杂化方式有SP2、SP3,甲苯能被酸性KMnO4溶液氧化成苯甲酸(
)中碳原子的杂化方式有SP2、SP3,甲苯能被酸性KMnO4溶液氧化成苯甲酸(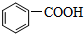 ),苯甲酸的沸点明显高于甲苯,其主要原因是苯甲酸分子间存在氢键.
),苯甲酸的沸点明显高于甲苯,其主要原因是苯甲酸分子间存在氢键.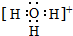 ,H3O+的键角大于(填“大于”、“小于”或“等于”)水分子的键角.
,H3O+的键角大于(填“大于”、“小于”或“等于”)水分子的键角.