题目内容
12.下列化合物中,含有非极性共价键的离子化合物是( )| A. | C2H4 | B. | CaCl2 | C. | Na2O2 | D. | NH4NO3 |
分析 活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,含有离子键的化合物是离子化合物,据此分析解答.
解答 解:A.乙烯分子中C-H原子之间只存在极性键、C-C原子之间只存在非极性键,为共价化合物,故A错误;
B.氯化钙中钙离子和氯离子之间只存在离子键,为离子化合物,故B错误;
C.过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在非极性键,为离子化合物,故C正确;
D.硝酸铵中铵根离子和酸根离子之间存在离子键、N-H和N-O原子之间存在极性键,为离子化合物,故D错误;
故选C.
点评 本题考查化学键及化合物类型判断,明确物质的构成微粒及微粒之间作用力即可解答,注意离子键和共价键、离子化合物和共价化合物之间的区别,易错选项是B.

练习册系列答案
相关题目
2.原子核外电子排布式为[Ar]3d54s2的元素是( )
| A. | Cr | B. | ds 区元素 | C. | ⅡA族元素 | D. | ⅦB族元素 |
3.25℃时,下列各溶液中关系的叙述中,正确的是( )
| A. | pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则c (Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 等物质的量浓度的NH4HSO4、NH4HCO3溶液中c(NH4+)大小:NH4HSO4>NH4HCO3 | |
| C. | 0.1 mol/L HA(某酸)溶液pH≠1,0.1 mol/L BOH(某碱)溶液中c(OH-)=0.1 mol/L,则BA(盐)溶液pH<7 | |
| D. | 4种pH相同的溶液①CH3COONa ②C6H5ONa ③NaHCO3 ④NaOH中c(Na+)的大小顺序是①>②>③>④ |
20.铁单质及其化合物在生活、生产中应用广泛.请回答:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为O2+2H2O+4e-=4OH-.
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+.
(3)若将(2)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式.
正极反应Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)
负极反应Cu=2Cu2++2e-(或Cu-2e-=Cu2+).
(4)下表中,对陈述I、Ⅱ的正确性及其有无因果关系的判断都正确的是B(填字母).
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为O2+2H2O+4e-=4OH-.
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+.
(3)若将(2)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式.
正极反应Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)
负极反应Cu=2Cu2++2e-(或Cu-2e-=Cu2+).
(4)下表中,对陈述I、Ⅱ的正确性及其有无因果关系的判断都正确的是B(填字母).
| 陈述I | 陈述Ⅱ | 判断 | |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | I对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁得到铁 | I对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁的某些化合物可用作催化剂 | I错;Ⅱ对;无 |
| D | 在空气中铁表面形成致密氧化膜 | 铁不能与氧气反应 | I对;Ⅱ对;有 |
7.常温下,下列有关溶液的说法不正确的是( )
| A. | pH=3的二元弱酸H2R溶液与 pH=11的NaOH溶液混合后,混合液的pH等于7,则混合液中c(R2-)>c(Na+)>c(HR-) | |
| B. | 将0.2 mol/L的某一元弱酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液中存在:2c(OH-)+c(A-)=2c(H+)+c(HA) | |
| C. | 某物质的水溶液中由水电离出的c(H+)=1×10-amol/L,若a>7,则该溶液的pH为a或14-a | |
| D. | 相同温度下,0.2mol/L的醋酸溶液与0.1mol/L的醋酸溶液中c(H+)之比小于2:1 |
17.下列变化或事实与范德华力无关的是( )
| A. | 气体物质加压或降温时能凝结或凝固 | |
| B. | 碘溶于四氯化碳 | |
| C. | 氟、氯、溴、碘单质的熔沸点依次升高 | |
| D. | 食盐熔化 |
1.A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1.E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同.

试回答:
(1)元素E在元素周期表中的位置是第三周期ⅣA族.
(2)与元素D离子所含电子数和质子数均相同的微粒是NH4+ (或H3O+).
(用化学式作答,下同)
(3)B和E最高价氧化物对应的水化物,酸性较弱的为H2SiO3.若用上图2中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:ⅠHNO3,ⅡNa2SiO3,观察到的实验现象是中出现白色胶状沉淀.
(4)由以上五种元素组成的中学常见的物质,其组成和结构信息如下表:
①a含有的化学键有离子键、共价键;
②b与c反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2.

试回答:
(1)元素E在元素周期表中的位置是第三周期ⅣA族.
(2)与元素D离子所含电子数和质子数均相同的微粒是NH4+ (或H3O+).
(用化学式作答,下同)
(3)B和E最高价氧化物对应的水化物,酸性较弱的为H2SiO3.若用上图2中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:ⅠHNO3,ⅡNa2SiO3,观察到的实验现象是中出现白色胶状沉淀.
(4)由以上五种元素组成的中学常见的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A、C、D的盐 |
| b | C、D组成的化合物,且原子数之比为1:1 |
| c | 化学组成为AC2 |
②b与c反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2.
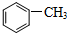 )中碳原子的杂化方式有SP2、SP3,甲苯能被酸性KMnO4溶液氧化成苯甲酸(
)中碳原子的杂化方式有SP2、SP3,甲苯能被酸性KMnO4溶液氧化成苯甲酸(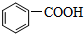 ),苯甲酸的沸点明显高于甲苯,其主要原因是苯甲酸分子间存在氢键.
),苯甲酸的沸点明显高于甲苯,其主要原因是苯甲酸分子间存在氢键.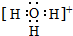 ,H3O+的键角大于(填“大于”、“小于”或“等于”)水分子的键角.
,H3O+的键角大于(填“大于”、“小于”或“等于”)水分子的键角.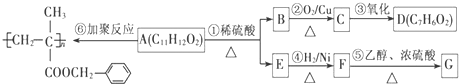
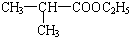 .
. .
.