题目内容
17. 现用如图装置来测定原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题:
现用如图装置来测定原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题:(1)b电极材料为铜,其电极反应式为2H++2e-═H2↑.
(2)如果将a、b两电极的电极材料对调,U形管中将出现的现象是左端溶夜下降,右端溶夜上升
(3)当量筒中收集到224mL(标准状况下)气体时,通过导线的电子的物质的量为0.02mol.
分析 (1)纯铜片和纯锌片、稀硫酸组成原电池,由图可知b电极处有氢气生成,则b为铜,为正极;a为锌,为负极;b上氢离子得电子生成氢气;
(2)如果将a、b两电极的电极材料对调,则右边为锌失电子作负极,左边为铜为正极,氢离子得电子生成氢气;
(3)根据电极方程式结合气体的物质的量求算电子的物质的量.
解答 解:(1)纯铜片和纯锌片、稀硫酸组成原电池,由图可知b电极处有氢气生成,则b为铜,为正极;a为锌,为负极;b上氢离子得电子生成氢气,其电极反应式为:2H++2e-═H2↑,
故答案为:铜;2H++2e-═H2↑;
(2)如果将a、b两电极的电极材料对调,则右边为锌失电子作负极,左边为铜为正极,氢离子得电子生成氢气,则左边上有氢气生成,所以U形管中左端溶夜下降,右端溶夜上升;故答案为:左端溶夜下降,右端溶夜上升;
(3)当量筒中收集到224mL(标准状况下)气体,则n(H2)=$\frac{V}{Vm}$=$\frac{0.224L}{22.4L/mol}$=0.01mol,已知b上的电极反应式为:2H++2e-═H2↑,则通过导线的电子的物质的量为0.02mol,故答案为:0.02mol.
点评 本题考查了原电池的工作原理知识,主要考查正负极的判断、电极方程式的书写、电子守恒在计算中的应用等,注意知识的积累是解题关键,难度中等.

练习册系列答案
相关题目
20.铁单质及其化合物在生活、生产中应用广泛.请回答:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为O2+2H2O+4e-=4OH-.
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+.
(3)若将(2)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式.
正极反应Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)
负极反应Cu=2Cu2++2e-(或Cu-2e-=Cu2+).
(4)下表中,对陈述I、Ⅱ的正确性及其有无因果关系的判断都正确的是B(填字母).
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为O2+2H2O+4e-=4OH-.
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+.
(3)若将(2)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式.
正极反应Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)
负极反应Cu=2Cu2++2e-(或Cu-2e-=Cu2+).
(4)下表中,对陈述I、Ⅱ的正确性及其有无因果关系的判断都正确的是B(填字母).
| 陈述I | 陈述Ⅱ | 判断 | |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | I对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁得到铁 | I对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁的某些化合物可用作催化剂 | I错;Ⅱ对;无 |
| D | 在空气中铁表面形成致密氧化膜 | 铁不能与氧气反应 | I对;Ⅱ对;有 |
1.A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1.E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同.

试回答:
(1)元素E在元素周期表中的位置是第三周期ⅣA族.
(2)与元素D离子所含电子数和质子数均相同的微粒是NH4+ (或H3O+).
(用化学式作答,下同)
(3)B和E最高价氧化物对应的水化物,酸性较弱的为H2SiO3.若用上图2中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:ⅠHNO3,ⅡNa2SiO3,观察到的实验现象是中出现白色胶状沉淀.
(4)由以上五种元素组成的中学常见的物质,其组成和结构信息如下表:
①a含有的化学键有离子键、共价键;
②b与c反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2.

试回答:
(1)元素E在元素周期表中的位置是第三周期ⅣA族.
(2)与元素D离子所含电子数和质子数均相同的微粒是NH4+ (或H3O+).
(用化学式作答,下同)
(3)B和E最高价氧化物对应的水化物,酸性较弱的为H2SiO3.若用上图2中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:ⅠHNO3,ⅡNa2SiO3,观察到的实验现象是中出现白色胶状沉淀.
(4)由以上五种元素组成的中学常见的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A、C、D的盐 |
| b | C、D组成的化合物,且原子数之比为1:1 |
| c | 化学组成为AC2 |
②b与c反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2.
5.下列变化中,不需要破坏化学键的是( )
| A. | 加热碳酸氢钠 | B. | 氯化氢溶于水 | C. | 食盐熔化 | D. | 干冰气化 |
12.分子式为C5H12O的有机物可以与Na反应放出H2,则其同分异构体中,含有三个甲基的有机物共有(不考虑立体异构)( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
2.有关化学用语正确的是( )
| A. | 乙烯的实验式:C2H4 | B. | 乙炔的电子式: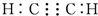 | ||
| C. | 乙醇的结构简式:C2H6O | D. | 氢氧根电子式: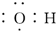 |
6.对于反应2SO2+O2$?_{加热}^{催化剂}$2SO3,下列判断正确的是( )
| A. | 2 mol SO2和足量的O2反应,可生成2 mol SO3 | |
| B. | 达到反应限度时SO2、O2、SO3的分子数之比一定为2:1:2 | |
| C. | 达到反应限度时SO2的消耗速率必定等于O2的生成速率的2倍 | |
| D. | 若反应在恒容容器中进行,气体密度保持不变,可以判定反应到达平衡 |
7. 拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图:下列对该化合物叙述正确的是( )
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图:下列对该化合物叙述正确的是( )
 拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图:下列对该化合物叙述正确的是( )
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图:下列对该化合物叙述正确的是( )| A. | 属于芳香烃 | B. | 不能发生取代反应 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 在一定条件下可以发生加成反应 |
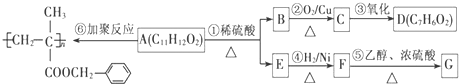
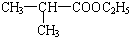 .
. .
.