题目内容
6.由甲酸甲酯、乙醛、丙酸三种物质组成的混合物,已知其中氧元素的质量分数为37%,则氢元素的质量分数为( )| A. | 63% | B. | 54% | C. | 12% | D. | 9% |
分析 甲酸甲酯为C2H4O2,乙醛为C2H4O,丙酸为C3H6O3,各分子中碳原子与氢原子数目之比为1:2,故混合物中碳元素与氢元素的质量之比为12:2=6:1,根据氧元素的质量分数计算混合物中碳元素与氢元素的质量分数之和,再根据碳元素与氢元素质量关系计算.
解答 解:甲酸甲酯为C2H4O2,乙醛为C2H4O,丙酸为C3H6O3,各分子中碳原子与氢原子数目之比为1:2,故混合物中碳元素与氢元素的质量之比为12:2=6:1,混合物中氧的质量分数为37%,则混合物中碳元素与氢元素的质量分数之和为1-37%=63%,故混合物中氢元素的质量分数=63%×$\frac{1}{1+6}$=9%,故选:D.
点评 本题考查混合物中元素的质量分数的计算,关键是各成分的化学式得出C、H的固定组成,学生应学会利用定组成的方法来解答混合物中元素的质量分数计算.

练习册系列答案
相关题目
17.下列选项中,符合如图所示关系的是( )
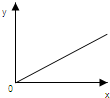

| A. | 一定状况下,气体摩尔体积(y)与该气体的物质的量(x)的关系 | |
| B. | 铁在氯气中燃烧,生成FeCl3的物质的量(y)与消耗氯气的物质的量(x)的关系 | |
| C. | 将铁在常温下放入浓硫酸中,生成气体的物质的量(y)与消耗浓硫酸的物质的量(x)的关系 | |
| D. | H2SO4溶液的物质的量浓度(y)与其质量分数(x) 的关系 |
1.下列有关能量的判断或表示方法正确的是( )
| A. | 从C(s,石墨)═C(s,金刚石)△H=+1.9 kJ•mol-1,可知石墨比金刚石更稳定 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 | |
| C. | 由H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,可知含1 mol CH3COOH的溶液与含1 mol NaOH的溶液充分混合反应,放出的热量等于57.3 kJ | |
| D. | 2g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ•mol-1 |
11.在容积不变的密闭容器中存在如下反应:2A(g)+B(g)?3C(g);△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )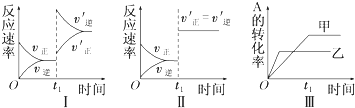

| A. | 图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响 | |
| B. | 图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响 | |
| C. | 图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高 | |
| D. | 图Ⅲ表示的是不同催化剂对平衡的影响,且甲的催化效率比乙高 |
18.下列物质中能使干燥的红色石蕊试纸变蓝色的是( )
| A. | 氨气 | B. | 氨水 | C. | 液氨 | D. | 氯化铵 |
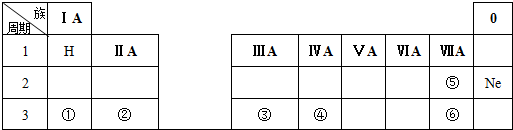
15.下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是Ne,可用于制半导体材料的元素是Si.
(2)B的最高价氧化物对应的水化物与C的单质反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
(3)最高价氧化物对应的水化物中酸性最强的是HClO4;
(4)A分别与D、E、G、H形成的化合物中,最稳定的是HF;
(5)在B、C、D中,原子半径由大到小的顺序是Na>Al>C.
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
(2)B的最高价氧化物对应的水化物与C的单质反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
(3)最高价氧化物对应的水化物中酸性最强的是HClO4;
(4)A分别与D、E、G、H形成的化合物中,最稳定的是HF;
(5)在B、C、D中,原子半径由大到小的顺序是Na>Al>C.
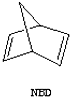 $?_{暗处}^{光照}$
$?_{暗处}^{光照}$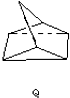 △H=+88.62kJ/mol
△H=+88.62kJ/mol .若用氯原子取代NBD分子中的一个H原子,可得到的同分异构体共有3种.
.若用氯原子取代NBD分子中的一个H原子,可得到的同分异构体共有3种.