题目内容
19.某物质有以下性质:①是电解质 ②溶解时有化学键的破坏 ③熔化时没有化学键的破坏,则该物质固态时属于( )| A. | 原子晶体 | B. | 离子晶体 | C. | 分子晶体 | D. | 金属晶体 |
分析 根据晶体中构成微粒以及微粒之间的作用力分析,分子晶体在熔化时不破坏化学键.
解答 解:已知某物质有以下性质:①是电解质 ②溶解时有化学键的破坏 ③熔化时没有化学键的破坏,
A.原子晶体在熔化时破坏共价键,破坏了化学键,故A不选;
B.离子晶体在熔化时破坏离子键,破坏了化学键,故B不选,
C.分子晶体在熔化时不破坏化学键,如HCl,属于电解质,溶于水发生电离破坏化学键,熔化时没有化学键的破坏,故C选.
D.金属晶体熔化时破坏金属键,破坏了化学键,故D不选.
故选C.
点评 本题考查了不同晶体的物理性质,题目难度不大,注意把握晶体的构成微粒和微粒间的作用力.

练习册系列答案
相关题目
9.某芳香烃的分子式为C10H14,不能使溴水褪色,分子结构中只含有一个侧链烃基,则此侧链烃基的结构共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
10.用惰性电极电解下列溶液,电解一段时间后,阴极质量增加,电解液的pH下降的是( )
| A. | CuSO4 | B. | NaOH | C. | BaCl2 | D. | H2SO4 |
7.下列反应属于吸热反应的是( )
| A. | 甲烷在空气中燃烧 | B. | 碳酸钙受热分解 | ||
| C. | 镁条溶于盐酸 | D. | 过氧化钠与水反应 |
4.可逆反应:A+B?C,在低温下能自发进行,在高温下不能自发进行,对该反应过程△H、△S的判断正确的是( )
| A. | △H>0、△S>0 | B. | △H<0、△S<0 | C. | △H<0、△S>0 | D. | △H>0、△S<0 |
11.在容积不变的密闭容器中存在如下反应:2A(g)+B(g)?3C(g);△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )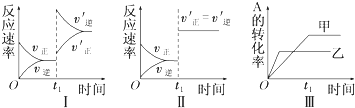

| A. | 图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响 | |
| B. | 图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响 | |
| C. | 图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高 | |
| D. | 图Ⅲ表示的是不同催化剂对平衡的影响,且甲的催化效率比乙高 |
8.下列关于化学反应限度的说法中不正确的是( )
| A. | 当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度 | |
| B. | 当一个可逆反应达到平衡状态时,各组分浓度不变,v(正)=v(逆)=0 | |
| C. | 任何可逆反应的进程都有一定的限度,只是不同的反应限度不同 | |
| D. | 化学反应的限度可以通过改变条件而改变 |
9.下列有关说法正确的是( )
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol•L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) | |
| D. | 常温下,向0.1 mol•L-1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的10倍 |