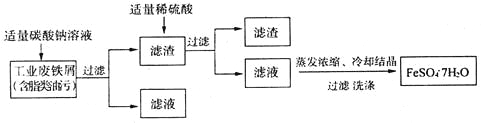
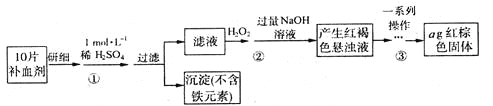
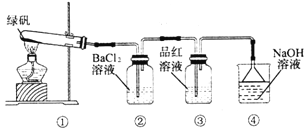
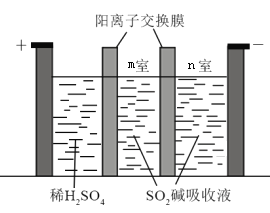
题目内容
【题目】室温下,分别用0.1mol/L溶液进行下列实验,结论不正确的是![]()
![]()
A.向![]() 溶液中通
溶液中通![]() 至
至![]() :c(Na+)=c(HCO3-)+ 2c(CO32-)
:c(Na+)=c(HCO3-)+ 2c(CO32-)
B.向![]() 溶液中加入等浓度等体积的盐酸:c(Na+)=c(Cl-)
溶液中加入等浓度等体积的盐酸:c(Na+)=c(Cl-)
C.向![]() 溶液中加入等浓度等体积的
溶液中加入等浓度等体积的![]() 溶液:pH=13
溶液:pH=13
D.向氨水中加入少量![]() 固体:
固体:![]() 增大
增大
【答案】C
【解析】
A.向NaHCO![]() 溶液中通CO
溶液中通CO![]() 至
至![]() ,
,![]() ,结合电荷守恒可知:
,结合电荷守恒可知:![]() ,故A正确;
,故A正确;
B.向CH![]() COONa溶液中加入等浓度等体积的盐酸,钠离子和氯离子的物质的量相等,则:
COONa溶液中加入等浓度等体积的盐酸,钠离子和氯离子的物质的量相等,则:![]() ,故B正确;
,故B正确;
C.向NaHSO![]() 溶液中加入等浓度等体积的
溶液中加入等浓度等体积的![]() 溶液,设溶液体积都是1L,反应后溶液中氢氧根离子浓度为:
溶液,设溶液体积都是1L,反应后溶液中氢氧根离子浓度为:![]() ,溶液中氢氧根离子浓度不是
,溶液中氢氧根离子浓度不是![]() ,溶液的
,溶液的![]() ,故C错误;
,故C错误;
D.氨水中加入少量NH![]() Cl固体,铵根离子浓度增大,抑制了一水合氨的电离,导致溶液中氢氧根离子浓度减小,而
Cl固体,铵根离子浓度增大,抑制了一水合氨的电离,导致溶液中氢氧根离子浓度减小,而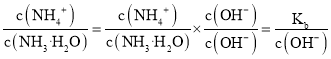 ,所以该比值增大,故D正确。
,所以该比值增大,故D正确。
故选C。

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
【题目】下列实验操作现象以及所得到的结论均正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向2mL 10%的NaOH溶液中加入4~6滴2%的CuSO4溶液,振荡后再加入0.5mL有机物Y,加热,未出现砖红色沉淀 | Y中不含有醛基 |
B | 在空气中加热金属铜变黑后,迅速伸入装有乙醇的试管中,金属铜恢复为原来的亮红色 | 乙醇发生了氧化反应 |
C | 向盛有苯酚浓溶液的试管中逐滴加入几滴稀溴水,边加边振荡,试管中产生了白色沉淀 | 苯酚和溴发生了取代反应生成三溴苯酚 |
D | 向10mL饱和Na2CO3溶液中加入2滴0.1mol/L的醋酸溶液,溶液中立即产生了气泡 | 醋酸酸性比碳酸强 |
A.AB.BC.CD.D