题目内容
【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年来,我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+ H2(g)![]() H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2= -90.0 kJmol-1
CH3OH(g) ΔH2= -90.0 kJmol-1
写出CO2催化氢化合成甲醇的热化学方程式_________。
(2)为提高CH3OH产率,理论上应采用的条件是_________(填字母)。
a 高温高压 b 低温低压 c 高温低压 d 低温高压
(3)250℃、在体积为2.0 L的恒容密闭容器中加入6 mol H2、2 mol CO2和催化剂,10 min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
① 前10 min的平均反应速率v(H2)=______ mol·L-1·min-1。
② 化学平衡常数的值 ______。
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。

① 补全上图:图中A处应填入_____。
② 该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的Δ H_____(填“变大”“变小”或“不变”)。
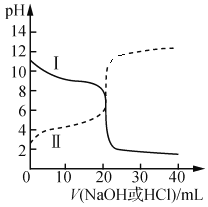
(5)CO2还可以与CH4反应生成CH3COOH。反应历程如下图1。(中间体的能量关系如虚框中曲线所示) 室温下某溶液中CH3COOH和CH3COO-两种微粒浓度随pH变化的曲线,如下图2。
①中间体①的能量______中间体②的能量。(填:“>”或“=”或“<”)
②从图2中得出,室温下,CH3COOH的电离常数值为____。

【答案】CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-48.9kJ/mol d 0.225 5.3 1mol CO2(g)+3mol H2(g) 不变 > 10-4.76
【解析】
(1)利用已知热化学方程式,求出CO2催化氢化合成甲醇的热化学方程式。
(2)该反应为体积缩小的放热反应,所以应加压、降温。
(3)利用三段式,可计算出反应速率及平衡常数。
(4)催化剂能加快反应速率,但不能改变反应的热效应。
(5)从图中可看出两中间体的能量关系;找出图中的特殊点,可计算出电离常数。
(1)已知:CO2(g)+ H2(g)![]() H2O(g)+CO(g) ΔH1 = + 41.1 kJmol-1
H2O(g)+CO(g) ΔH1 = + 41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2= -90.0 kJmol-1
CH3OH(g) ΔH2= -90.0 kJmol-1
将两热化学方程式相加,即可得出CO2催化氢化合成甲醇的热化学方程式:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g) △H=-48.9kJ/mol,
答案:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-48.9kJ/mol。
(2)因为此反应为放热的体积缩小的可逆反应,所以为提高CH3OH产率,理论上应采用的条件是加压、降温;
答案:d。
(3) CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
起始量 1mol/L 3mol/L 0 0
变化量 0.75mol/L 2. 25mol/L 0.75mol/L 0.75mol/L
平衡量 0.25mol/L 0.75mol/L 0.75mol/L 0.75mol/L
① 前10 min的平均反应速率v(H2)=![]() mol·L-1·min-1;
mol·L-1·min-1;
答案:0.225。
② 化学平衡常数的值![]() ;
;
答案:5.3。
(4)① 图中A处应填入1mol CO2(g)+3mol H2(g);
答案:1mol CO2(g)+3mol H2(g)。
② 因为催化剂不能改变反应物的转化率,所以加入催化剂后,该反应的Δ H不变;
答案:不变。
(5)①从图中可以看出,中间体①的能量>中间体②的能量;
答案:>
②我们选择两条曲线的交叉点,在此点c(CH3COO-)= c(CH3COOH),且c(H+)=10-4.76,
室温下,CH3COOH的电离常数值为![]() ;
;
答案:10-4.76

 科学实验活动册系列答案
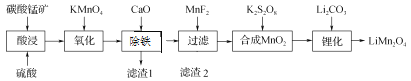
科学实验活动册系列答案【题目】工业上以碳酸锰矿(主要成分为MnCO3,另含FeO、Fe2O3、CaO等杂质)为主要原料生产锰酸锂(LiMn2O4)的工艺流程如下:
已知:部分离子沉淀的pH值。
离子 | 开始沉淀的pH值 | 沉淀完全时的pH值 |
Mn2+ | 8.8 | 10.8 |
Fe2+ | 7.5 | 9.5 |
Fe3+ | 2.2 | 3.5 |
(1) 为了提高碳酸锰矿浸岀的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③_____等。
(2) 氧化时发生的离子方程式:_________。
(3) 加入CaO“除铁”的原理是____________。
(4) 加入MnF2为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为________mol·L-1[常温时,Ksp(CaF2)=2.7×10-11]。
(5) “锂化”是将MnO2和Li2CO3按4∶1的物质的量比配料,球磨3~5 h,然后升温至600~750 ℃,保温24 h,自然冷却至室温得产品。升温到515 ℃时,开始有CO2产生,比预计碳酸锂的分解温度(723 ℃)低得多。可能的原因是________。