题目内容
【题目】化学实验是学习理解化学知识的基础,它以其魅力和丰富的内涵在化学学习中发挥着独特的功能和作用。请回答下列问题:
实验室欲配制100mL1mol·L-1的Na2CO3溶液。
(1)配制上述溶液,下列没有用到的仪器是__(填标号)。
A.烧杯 B.大试管 C.胶头滴管 D.100mL容量瓶
(2)除上述仪器外,还一定用到的玻璃仪器是__。
(3)从下表中选择称量Na2CO3·10H2O固体所需要的仪器有__(填标号)。
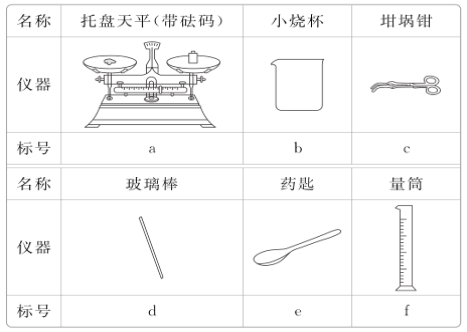
(4)下列情况使所配溶液的浓度如何变化?
①未洗涤溶解Na2CO3·10H2O的烧杯__(填“偏大”“偏小”或“不变”,后同)。
②容量瓶使用前用蒸馏水洗过,内壁附有水珠__。
③定容时加蒸馏水超过了刻度线,将多出的液体吸出__。
④定容时俯视容量瓶刻度线__。
【答案】B 玻璃棒 abe 偏小 不变 偏小 偏大
【解析】
欲配制100mL1mol·L-1的Na2CO3溶液,需经过计算、称量、溶解、洗涤、转移、定容等步骤,所需的仪器有托盘天平、烧杯、玻璃棒、100mL容量瓶、胶头滴管等。
(1)综上分析,实验过程不需要大试管,答案选B。
(2)除烧杯、100mL容量瓶、胶头滴管等玻璃仪器外,还需玻璃棒。
(3)称量Na2CO3·10H2O固体需要托盘天平,Na2CO3·10H2O固体应置于小烧杯中进行称量并用药匙取用固体,答案选ade。
(4)①未洗涤溶解Na2CO3·10H2O的烧杯,会造成溶质损失,则浓度偏小。
②容量瓶使用前用蒸馏水洗过,内壁附有水珠,对溶液浓度无影响,浓度不变。
③定容时加蒸馏水超过了刻度线,将多出的液体吸出的的同时溶质的量减少,浓度偏小。
④定容时俯视容量瓶刻度线,则溶液体积偏小,浓度偏大。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】下列实验操作及现象能够达到对应实验目的是( )
选项 | 实验操作及现象 | 实验目的 |
A | 向溶液中加入盐酸无现象,再加入氯化钡溶液产生白色沉淀 | 检验溶液中有 |
B | 常温下,向饱和 | 证明常温下, |
C | 常温下,测定盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于 |
D | 将浓硫酸与碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中 |
A.AB.BC.CD.D


