��Ŀ����
����Ŀ��ij�о���ѧϰС����̽��FeSO4��7H2O���̷�������Ҫ��ѧ���ʺ���;��
I��FeSO4��7H2O���̷����㷺����ҽҩ��ҵ����������FeSO4��7H2O��ʵ�����Ʊ�����ͼ��
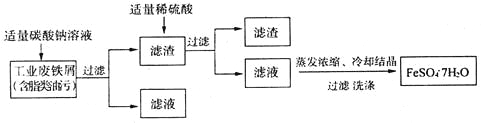
��������ش��������⣺
��1��̼������Һ�ܳ�ȥ֬����������Ϊ_________________���ñ�Ҫ������˵������
��2������м�к���������Fe2O3�����Ʊ������������ȥ��������___________________���ñ�Ҫ�����ӷ���ʽ˵������
II��Ϊ�ⶨij��Ѫ������Ч�ɷ�ΪFeSO4��7H2O������Ԫ�غ��������ʵ���������£��ش��������⣺
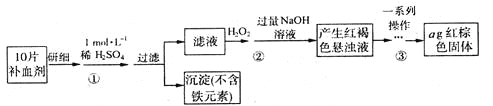
��1����������Ҫ��Ũ���ᣨ��������Ϊ98.3 %������100 mL 1 mol��L-1��ϡ���ᣬ���õIJ�����������Ͳ���ձ�������������ͷ�ιܼ�____________��
��2������������ʾ��һϵ�в��������ǣ�
a������
b.ϴ��
c��__________
d����ȴ
e������
f���ظ�c��eֱ��������������
����f��Ŀ����_________________________________________________________��
��3������ʵ���������Ԫ������ģ���ÿƬ��Ѫ������Ԫ��Ϊ________g���ú�n�Ĵ���ʽ��ʾ����
III��������ͼװ��̽���̷������ȶ���
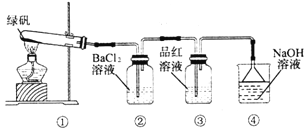
��1��ʵ������У��۲쵽����Ʒ����Һ��ɫ���ݴ��Ʋ�FeSO4�ֽ���������п��ܱ�������Ԫ����___________����д�����з�Ӧ�����ӷ���ʽ��____________________��
��2�������а�ɫ�������ɣ�С���Ա�������۷�������ϣ�1���еı����Ʋ⣬�̷��ֽ�IJ������п��������и����е�______________���������ĸ����
a��Fe2O3��SO3��H2O
b��Fe2O3��SO2��SO3��H2O
c��FeO��SO2��SO3��H2O
���𰸡�̼���ˮ��ʼ��ԣ��ڼ�����������֬��ˮ������������ˮ�����ʶ�����ȥ Fe2O3+6H+=2Fe3++3H2O��2Fe3++Fe=3Fe2+�� Fe2O3+Fe+ 6H+=3Fe2++3H2O 100mL����ƿ ���գ����ȣ� ʹ����������ȫ�ֽ����������� 0.07a Fe 2OH-+ SO2= SO32-+H2O ��OH-+ SO2= HSO3- b
��������
����м�к����������ۣ�Na2CO3Ϊǿ�������Σ�CO32-ˮ������HCO3-��OH-�����ߴٽ�CO32-ˮ�⣬��ٽ���֬ˮ�⣬Ȼ�����ϴ�ӣ�����ϡ���ᣬ������ӦIIΪFe+H2SO4=FeSO4+H2�������ȹ��ˡ���ȴ�ᾧ������ϴ�ӵõ�FeSO47H2O��
����Ѫ����ϸ����ҩƬ�м���ϡ���ᣬȻ����˵õ�����������Һ�м���˫��ˮ��������Ӧ2Fe2++H2O2+2H+=2Fe3++2H2O������Һ�м������X��Һ���ɺ��ɫ��������XΪ������ɫ�������յõ�����ɫ����Fe2O3���ݴ˷������
���̷����������Ӿ��л�ԭ�ԣ�����β������װ�ã�����������NaOH��Һ��Ӧ���ݷ�Ӧ�����֪���̷��ֽ������˶���������������������ԭ��Ӧ�л��ϼ��н������������������������ɡ�
I����1��̼������Һ�ܳ�ȥ������������Ϊ̼���ˮ��ʼ��ԣ��ڼ�����������֬��ˮ������������ˮ�����ʶ�����ȥ��
��2�����˺�õ���������Fe2O3��Fe�Ļ������������ᷢ����Ӧ��Fe2O3������ᷴӦ�����ɵ�Fe3+�������Ӧ����ȥ������Fe2O3���ó�ȥ����Ӧ���ӷ���ʽ�У�Fe2O3+6H+=2Fe3++3H2O��2Fe3++Fe=3Fe2+��
II.��1������һ�����ʵ���Ũ�ȵ���Һһ��Ҫ�õ�����ƿ��ѡ��100mL����ƿ��
��2�����ɵĺ��ɫ������Fe��OH��3������ɫ������Fe2O3��Ҫ��Fe��OH��3,ת��ΪFe2O3��Ҫ���ջ���ȣ��ظ�c��eֱ����������������Ϊ��ʹ����������ȫ�ֽ�������������
��3��Fe2O3������Ϊag�����е���Ԫ������Ϊ��112/160g=0.7a������ÿƬ��Ѫ������Ԫ��Ϊ0.07a g��
III.��1��Ʒ����ɫ˵����SO2���ɣ�SԪ�ػ��ϼ۽��ͣ���ô��Ԫ�ػ��ϼ۾�Ҫ���ߣ����Ա���������Fe Ԫ�� ������NaOH��Һ����SO2����Ӧ�����ӷ���ʽΪ��2OH-+ SO2= SO32-+H2O ��OH-+ SO2= HSO3-��
��2�������а�ɫ������������SO3���ɣ������̷��ֽ�IJ������п�����Fe2O3��SO2��SO3��H2O��ѡb��