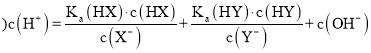题目内容
【题目】按要求完成下列各题。
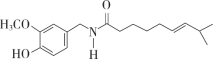
(1)如图是辣椒素中影响辣椒辣味的活性成分的其中一种分子的结构,其含有的官能团有_______种;含氧官能团的名称是________。
(2)有机物CH3CH(C2H5)CH(CH3)2的名称是________。
(3)为了测定芳香烃A的结构,做如下实验:
①将9.2g该芳香烃A完全燃烧,生成标况下15.68L CO2和7.2g H2O;
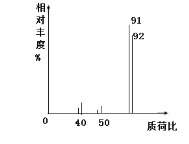
②用质谱仪测定其相对分子质量,得如图所示的质谱图,由图可知该分子的相对分子质量是________,则有机物A的分子式为________。
③用核磁共振氢谱测得该有机物有四个峰,且四个峰的面积之比是1∶2∶2∶3,则该有机物A的结构简式为________。
【答案】4 醚键、羟基、肽键 2,3-二甲基戊烷 92 C7H8 甲苯
【解析】
(1)由结构简式可知,该有机物含有醚键、羟基、肽键和碳碳双键四种官能团;
(2)有机物CH3CH(C2H5)CH(CH3)2属于烷烃,分子中最长碳链有5个碳原子,侧链为2个甲基;
(3)由质谱图可知,芳香烃A的相对分子质量为92,9.2g,芳香烃A的物质的量为0.1mol,由完全燃烧生成标况下15.68L CO2和7.2g H2O可知,分子中含有的C原子的物质的量为![]() =0.7mol,H原子的物质的量为
=0.7mol,H原子的物质的量为![]() ×2=0.8mol,则n:n(C):n(H)=0.1:0.7:0.8=1:7:8,则分子式为C7H8。
×2=0.8mol,则n:n(C):n(H)=0.1:0.7:0.8=1:7:8,则分子式为C7H8。
(1)由结构简式可知,该有机物含有醚键、羟基、肽键和碳碳双键四种官能团,其中醚键、羟基、肽键属于含氧官能团,故答案为:4;醚键、羟基、肽键;
(2)有机物CH3CH(C2H5)CH(CH3)2属于烷烃,分子中最长碳链有5个碳原子,侧链为2个甲基,名称为2,3-二甲基戊烷,故答案为:2,3-二甲基戊烷;
(3)②由质谱图可知,芳香烃A的相对分子质量为92,9.2g芳香烃A的物质的量为0.1mol,由完全燃烧生成标况下15.68L CO2和7.2g H2O可知,分子中含有的C原子的物质的量为![]() =0.7mol,H原子的物质的量为
=0.7mol,H原子的物质的量为![]() ×2=0.8mol,则n:n(C):n(H)=0.1:0.7:0.8=1:7:8,则分子式为C7H8,故答案为:92;C7H8;
×2=0.8mol,则n:n(C):n(H)=0.1:0.7:0.8=1:7:8,则分子式为C7H8,故答案为:92;C7H8;
③由核磁共振氢谱有四个峰,且四个峰的面积之比是1∶2∶2∶3可知,芳香烃A为甲苯,结构简式为![]() ,故答案为:
,故答案为:![]() 。
。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
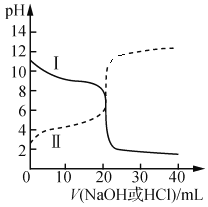
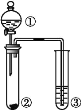
三点一测快乐周计划系列答案【题目】利用如图所示装置进行以下实验,能得到相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓氨水 | NaOH | 酚酞 | NaOH 的碱性比 NH3·H2O 的强 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 浓硫酸 | Cu | Na2S | SO2 具有氧化性 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3 | 非金属性:N>C>Si |
A.AB.BC.CD.D