��Ŀ����
����Ŀ��Na2SO3��NaHSO3��Na2S2O5������ʳƷ��ҵ��Ư������������������������֪��1molL��1Na2SO3��Һ��pH��9��1molL��1NaHSO3��Һ��pH��5��
(1)NaHSO3��Һ��pH��5��ԭ����_______(�û�ѧ���ﲢ�������˵���ش�)��
(2)��ͬѧ������ۣ�Ӧ����ѧ֪ʶ���������ͼ��ʾʵ�飬���ֱպϿ��غ�����������ָ�뷢��ƫת��

��
��a�缫Ϊ_______(��������������������)���缫��ӦʽΪ��______________��
��ȡ����Na2SO3��Һ�缫�����Ļ��Һ������_______��������ɫ������֤��������![]() ��
��
(3)�Ʊ�Na2S2O5Ҳ�ɲ�������Ĥ��⼼����װ����ͼ��ʾ������SO2������Һ�к���NaHSO3��Na2SO3���������ĵ缫��ӦʽΪ_____________������_____________�ҵ�NaHSO3Ũ�����ӡ�
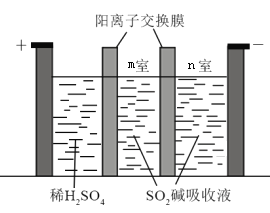
(4)��ͬѧ�ⶨ������ij�ɺ����Ѿ���Na2S2O5��������ȡ50.00 mL���Ѿ���Ʒ����ƿ�У���װ��0.010 mol��L1���Һ��_________(������ʽ��������ʽ��)�ζ��ܵζ����յ㣬���ı�Һ10.00 mL������Ʒ��Na2S2O5�IJ�����Ϊ____________g��L1(��SO2��)��(��֪��![]() )
)
���𰸡�NaHSO3��Һ����![]() H++
H++![]() �ĵ���ƽ���
�ĵ���ƽ���![]() +H2OH2SO3+OH-��ˮ��ƽ�⣬����ƽ�����ˮ��ƽ��������� ���� Fe3++e-=Fe2+ ���������BaCl2��Һ 2H2O��4e��=4H++O2�� m ��ʽ 0.128
+H2OH2SO3+OH-��ˮ��ƽ�⣬����ƽ�����ˮ��ƽ��������� ���� Fe3++e-=Fe2+ ���������BaCl2��Һ 2H2O��4e��=4H++O2�� m ��ʽ 0.128
��������
���������Ϣ���Ƚϵ���ˮ��̶ȷ���1molL��1NaHSO3��Һ��pH��5��ԭ����ԭ��غ͵��ع���ԭ���жϵ缫����д�缫��Ӧʽ�����ݻ�ѧ��Ӧ����ʽ�ù�ϵʽ������ؼ��㡣
(1)NaHSO3��Һ��![]() ͬʱ���ڵ���ƽ���ˮ��ƽ�⣺
ͬʱ���ڵ���ƽ���ˮ��ƽ�⣺![]() H++
H++![]() ��
��![]() +H2OH2SO3+OH-���ҵ���̶ȴ���ˮ��̶ȣ��������ԣ�
+H2OH2SO3+OH-���ҵ���̶ȴ���ˮ��̶ȣ��������ԣ�
(2)ָ�뷢��ƫת��˵��������ԭ��أ�a�缫��Һ��Fe3+���������ԣ��õ��ӣ�aΪ�������缫��ӦʽΪ![]() ��b�缫��Һ��
��b�缫��Һ��![]() ���л�ԭ�ԣ�ʧ���ӣ�bΪ�������缫��ӦʽΪ
���л�ԭ�ԣ�ʧ���ӣ�bΪ�������缫��ӦʽΪ![]() ������
������![]() ѡ�����������BaCl2��Һ��
ѡ�����������BaCl2��Һ��
(3)����������ʧ���ӷ���������Ӧ����������ϡ![]() ��OH-�ŵ磬�缫��ӦʽΪ2H2O��4e��=4H++O2����������H+���࣬ͨ�������ӽ���Ĥ����m�ң���Na2SO3��Ӧ����NaHSO3��m��NaHSO3���ӣ�����H+�ŵ磬OH-���࣬��NaHSO3��Ӧ����Na2SO3��n��NaHSO3���٣�
��OH-�ŵ磬�缫��ӦʽΪ2H2O��4e��=4H++O2����������H+���࣬ͨ�������ӽ���Ĥ����m�ң���Na2SO3��Ӧ����NaHSO3��m��NaHSO3���ӣ�����H+�ŵ磬OH-���࣬��NaHSO3��Ӧ����Na2SO3��n��NaHSO3���٣�
(4)![]() ��
��![]() ���������ԣ�Ӧ����ʽ�ζ��ܵμӣ����ĵ�
���������ԣ�Ӧ����ʽ�ζ��ܵμӣ����ĵ�![]() ����
����![]() ������Ϊ
������Ϊ![]() ��
��

 �����Ļ�������ҵϵ�д�
�����Ļ�������ҵϵ�д�����Ŀ������ʵ������������ܹ��ﵽ��Ӧʵ��Ŀ����( )
ѡ�� | ʵ����������� | ʵ��Ŀ�� |
A | ����Һ�м��������������ټ����Ȼ�����Һ������ɫ���� | ������Һ���� |
B | �����£��� | ֤�������£� |
C | �����£��ⶨ����ʹ�����Һ��pH������pHС�ڴ���pH | ֤����ͬ�����£���ˮ��HCl����̶ȴ��� |
D | ��Ũ������̼��ϼ��ȣ�ֱ�ӽ����ɵ�����ͨ�������ij���ʯ��ˮ��ʯ��ˮ����� | ������������� |
A.AB.BC.CD.D
