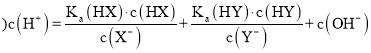ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩœ¬Ν– Β―ι≤ΌΉςœ÷œσ“‘ΦΑΥυΒΟΒΫΒΡΫα¬έΨυ’ΐ»ΖΒΡ «
―Γœν | Β―ι≤ΌΉςΚΆœ÷œσ | Β―ιΫα¬έ |
A | œρ2mL 10%ΒΡNaOH»ή“Κ÷–Φ”»κ4~6ΒΈ2%ΒΡCuSO4»ή“ΚΘ§’ώΒ¥Κσ‘ΌΦ”»κ0.5mL”–ΜζΈοYΘ§Φ”»»Θ§Έ¥≥ωœ÷Ή©Κλ…Ϊ≥ΝΒμ | Y÷–≤ΜΚ§”–»©Μυ |
B | ‘ΎΩ’Τχ÷–Φ”»»Ϋπ τΆ≠±δΚΎΚσΘ§―ΗΥΌ…λ»κΉΑ”–““¥ΦΒΡ ‘Ιή÷–Θ§Ϋπ τΆ≠Μ÷Η¥ΈΣ‘≠ά¥ΒΡΝΝΚλ…Ϊ | ““¥ΦΖΔ…ζΝΥ―θΜ·Ζ¥”Π |
C | œρ Δ”–±ΫΖ”≈®»ή“ΚΒΡ ‘Ιή÷–÷πΒΈΦ”»κΦΗΒΈœΓδεΥ°Θ§±ΏΦ”±Ώ’ώΒ¥Θ§ ‘Ιή÷–≤ζ…ζΝΥΑΉ…Ϊ≥ΝΒμ | ±ΫΖ”ΚΆδεΖΔ…ζΝΥ»Γ¥ζΖ¥”Π…ζ≥…»ΐδε±ΫΖ” |
D | œρ10mL±ΞΚΆNa2CO3»ή“Κ÷–Φ”»κ2ΒΈ0.1mol/LΒΡ¥ΉΥα»ή“ΚΘ§»ή“Κ÷–ΝΔΦ¥≤ζ…ζΝΥΤχ≈ί | ¥ΉΥαΥα–‘±»ΧΦΥα«Ω |
A.AB.BC.CD.D
ΓΨ¥πΑΗΓΩAB
ΓΨΫβΈωΓΩ
AΘ°œρ2 mL 10%ΒΡNaOH»ή“Κ÷–Φ”»κ4~6ΒΈ2%ΒΡCuSO4»ή“ΚΘ§ΒΟΒΫ–¬÷Τ«β―θΜ·Ά≠–ϋΉ«“ΚΘ§«“ΦνΙΐΝΩΘ§Φλ―ι-CHO”Π‘ΎΦν–‘ΧθΦΰœ¬Θ§ΖϊΚœ“Σ«σΘ§’ώΒ¥Κσ‘ΌΦ”»κ0.5mL”–ΜζΈοYΘ§Φ”»»Θ§Έ¥≥ωœ÷Ή©Κλ…Ϊ≥ΝΒμΘ§ΥΒΟςΗΟ”–ΜζΈοY÷–≤ΜΚ§-CHOΘ§Ι A’ΐ»ΖΘΜ
BΘ°‘ΎΩ’Τχ÷–Φ”»»Ϋπ τΆ≠±δΚΎΘ§ΖΔ…ζ2Cu+O2![]() 2CuOΖ¥”ΠΘ§‘Ό―ΗΥΌ…λ»κΉΑ”–““¥ΦΒΡ ‘Ιή÷–Θ§Ϋπ τΆ≠Μ÷Η¥ΈΣ‘≠ά¥ΒΡΝΝΚλ…ΪΘ§ΖΔ…ζCH3CH2OH+CuO
2CuOΖ¥”ΠΘ§‘Ό―ΗΥΌ…λ»κΉΑ”–““¥ΦΒΡ ‘Ιή÷–Θ§Ϋπ τΆ≠Μ÷Η¥ΈΣ‘≠ά¥ΒΡΝΝΚλ…ΪΘ§ΖΔ…ζCH3CH2OH+CuO ![]() CH3CHO+H2O+CuΘ§ΧΦ‘ΣΥΊΜ·ΚœΦέ…ΐΗΏΘ§±Μ―θΜ·Θ§““¥ΦΖΔ…ζΝΥ―θΜ·Ζ¥”ΠΘ§Ι B’ΐ»ΖΘΜ
CH3CHO+H2O+CuΘ§ΧΦ‘ΣΥΊΜ·ΚœΦέ…ΐΗΏΘ§±Μ―θΜ·Θ§““¥ΦΖΔ…ζΝΥ―θΜ·Ζ¥”ΠΘ§Ι B’ΐ»ΖΘΜ
CΘ°”Π―Γ”Ο≈®δεΥ°Θ§œΓδεΥ°…ζ≥…ΒΡ»ΐδε±ΫΖ”»ή”Ύ±ΫΖ”÷–Θ§Ιέ≤λ≤ΜΒΫΑΉ…Ϊ≥ΝΒμΘ§Ι C¥μΈσΘΜ
DΘ° Β―ι÷–ΧΦΥαΡΤΙΐΝΩΘ§¥ΉΥα≤ΜΉψΘ§…ζ≥…ΧΦΥα«βΡΤΘ§ΈόΤχ≈ί≤ζ…ζΘ§Ι D¥μΈσΘΜ
¥πΑΗΈΣABΓΘ

ΓΨΧβΡΩΓΩΙΛ“Β…œ“‘ΧΦΥαΟΧΩσΘ®÷ς“Σ≥…Ζ÷ΈΣMnCO3Θ§ΝμΚ§FeOΓΔFe2O3ΓΔCaOΒ»‘”÷ Θ©ΈΣ÷ς“Σ‘≠Νœ…ζ≤ζΟΧΥαο°Θ®LiMn2O4Θ©ΒΡΙΛ“’Νς≥Χ»γœ¬ΘΚ
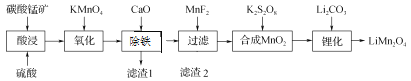
“―÷ΣΘΚ≤ΩΖ÷άκΉ”≥ΝΒμΒΡpH÷ΒΓΘ
άκΉ” | ΩΣ Φ≥ΝΒμΒΡpH÷Β | ≥ΝΒμΆξ»Ϊ ±ΒΡpH÷Β |
Mn2+ | 8.8 | 10.8 |
Fe2+ | 7.5 | 9.5 |
Fe3+ | 2.2 | 3.5 |
Θ®1Θ© ΈΣΝΥΧαΗΏΧΦΥαΟΧΩσΫΰ¨γΒΡΥΌ¬ Θ§‘ΎΓΑΥαΫΰΓ± ±Ω…≤…»ΓΒΡ¥κ ©”–ΘΚΔΌ Β±…ΐΗΏΈ¬Ε»ΘΜΔΎΫΝΑηΘΜΔέ_____Β»ΓΘ
Θ®2Θ© ―θΜ· ±ΖΔ…ζΒΡάκΉ”ΖΫ≥Χ ΫΘΚ_________ΓΘ
Θ®3Θ© Φ”»κCaOΓΑ≥ΐΧζΓ±ΒΡ‘≠άμ «____________ΓΘ
Θ®4Θ© Φ”»κMnF2ΈΣΝΥ≥ΐ»Ξ»ή“Κ÷–ΒΡCa2ΘΪΘ§»τΩΊ÷Τ»ή“Κ÷–FΘ≠≈®Ε»ΈΣ3ΓΝ10Θ≠3 molΓΛLΘ≠1Θ§‘ρCa2ΘΪΒΡ≈®Ε»ΈΣ________molΓΛLΘ≠1[≥ΘΈ¬ ±Θ§KspΘ®CaF2Θ©ΘΫ2.7ΓΝ10Θ≠11]ΓΘ
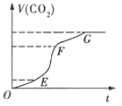
Θ®5Θ© ΓΑο°Μ·Γ± «ΫΪMnO2ΚΆLi2CO3Α¥4ΓΟ1ΒΡΈο÷ ΒΡΝΩ±»≈δΝœΘ§«ρΡΞ3ΓΪ5 hΘ§»ΜΚσ…ΐΈ¬÷Ν600ΓΪ750 ΓφΘ§±ΘΈ¬24 hΘ§Ή‘»Μά以÷Ν “Έ¬ΒΟ≤ζΤΖΓΘ…ΐΈ¬ΒΫ515 Γφ ±Θ§ΩΣ Φ”–CO2≤ζ…ζΘ§±»‘ΛΦΤΧΦΥαο°ΒΡΖ÷ΫβΈ¬Ε»Θ®723 ΓφΘ©ΒΆΒΟΕύΓΘΩ…ΡήΒΡ‘≠“ρ «________ΓΘ