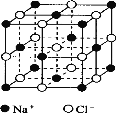
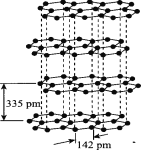
题目内容
【题目】计算多元弱酸(HnX)溶液的c(H+)及比较弱酸的相对强弱时,通常只考虑第一步电离。回答下列关于多元弱酸HnX的问题。
(1)若要使HnX溶液中c(H+)/c(HnX)增大,可以采取的措施是__________。
A.升高温度 B.加少量固态HnX C.加少量NaOH溶液 D.加水
(2)用离子方程式解释NanX呈碱性的原因:______________________________。
(3)若HnX为H2C2O4,且某温度下,H2C2O4的K1=5×10-2、K2=5×10-5.则该温度下,0.2mol/L H2C2O4溶液中c(H+)约为__________mol/L。(精确计算,且己知![]() )
)
(4)已知KHC2O4溶液呈酸性。
①KHC2O4溶液中,各离子浓度由大到小的顺序是____________________。
②在KHC2O4溶液中,各粒子浓度关系正确的是__________。
A.c(C2O42-)<c(H2C2O4)
B.c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C.c(K+)+c(H+)=c(OH-)+c(HC2O42-)+2c(C2O42-)
D.c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4)
【答案】(1)AD
(2)Xn-+H2O![]() X(n-1)-+OH-
X(n-1)-+OH-
(3)0.078
(4)①c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) ②CD
【解析】
试题分析:(1)弱电解质的电离为吸热过程,升温促进电离,则c(H+)/c(HnX)比值增大,A项正确;加少量固态HnX,HnX浓度增大,弱电解质的浓度越大,电离程度越小,则c(H+)/c(HnX)比值减小,B项错误;加入NaOH溶液,消耗氢离子,使c(H+)减小,则c(H+)/c(HnX)比值减小,C项错误;加水,溶液体积增大,导致氢离子、醋酸浓度都减小,但是电离平衡向正向移动,氢离子浓度减的少,HnX浓度减得大,c(H+)/c(HnX)比值增大,D项正确;答案选AD。
(2)HnX是弱酸,Xn-在水溶液中存在水解平衡:Xn-+H2O![]() X(n-1)-+OH-,所以NanX溶液呈碱性。
X(n-1)-+OH-,所以NanX溶液呈碱性。
(3)K1=c(H+)c(HC2O4-)÷c(H2C2O4) =5×10-2、K2=c(H+)c(C2O42-)÷c(HC2O4-)=5×10-5,解得,c(H+)=0.078mol/L;
(4)①KHC2O4溶液呈酸性,说明草酸氢根离子的电离程度大于其水解程度,所以溶液显酸性,c(H+)>c(OH-) 溶液中离子浓度大小为c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
② HC2O4-电离程度大于水解程度,c(C2O42-)>c(H2C2O4),A项错误;在KHC2O4溶液中,电荷守恒关系式为c(K+)+c(H+)=c(OH-)+c(HC2O42-)+2c(C2O42-),物料守恒关系式为c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4),C、D正确;由电荷守恒关系式和物料守恒关系式得c(C2O42-)+c(OH-)=c(H+)+c(HC2O4-)+ 2c(H2C2O4),B项错误;答案选CD。

 培优好卷单元加期末卷系列答案
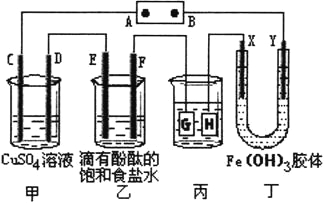
培优好卷单元加期末卷系列答案【题目】(l)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
①装置乙中正极的电极反应式是 。
②四种金属活动性由强到弱的顺序是 。
(2)由Zn一Cu一硫酸溶液组成的原电池,工作一段时间后锌片的质量减少了6.5g.回答下列问题:溶液中的H+移向 (填“正极”或“负极’) 。负极的电极反应式是 , 标准状况下生成 L气体。
(3)断开1 mol H一H键、1 mol N一H键、1 mol N≡N 键分别需要吸收能量为436KJ、391KJ、946KJ,求:H2与N2反应生成0.5 molNH3填(“吸收”或“放出”)能量 KJ。
(4)原子序数大于4的主族元素A和B的离子分别为Am+和Bn-,已知它们的核外电子排布相同,据此推断:
① A和B所属周期数之差为(填具体数字) 。
② A和B的核电荷数之差为(用含m或n的式子表示) 。
③ B和A的族序数之差为 .