题目内容
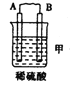
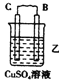
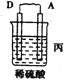
【题目】(l)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
①装置乙中正极的电极反应式是 。
②四种金属活动性由强到弱的顺序是 。
(2)由Zn一Cu一硫酸溶液组成的原电池,工作一段时间后锌片的质量减少了6.5g.回答下列问题:溶液中的H+移向 (填“正极”或“负极’) 。负极的电极反应式是 , 标准状况下生成 L气体。
(3)断开1 mol H一H键、1 mol N一H键、1 mol N≡N 键分别需要吸收能量为436KJ、391KJ、946KJ,求:H2与N2反应生成0.5 molNH3填(“吸收”或“放出”)能量 KJ。
(4)原子序数大于4的主族元素A和B的离子分别为Am+和Bn-,已知它们的核外电子排布相同,据此推断:
① A和B所属周期数之差为(填具体数字) 。
② A和B的核电荷数之差为(用含m或n的式子表示) 。
③ B和A的族序数之差为 .
【答案】(1)①Cu2++2e-=Cu ②D>A>B>C
(2)正极 Zn—2e—=Zn2+2.24
(3)放出 23(4)①1 ②m+n ③8-m-n
【解析】试题分析:(1)①乙装置中C的质量不断增加,说明C电极是正极,溶液中的铜离子放电生成铜,电极反应式是Cu2++2e-=Cu;
②甲中A是负极,B是正极;乙中C是正极,B是负极;丙中A是正极,D是负极,所以四种金属活泼性由强到弱的顺序是D>A>B>C。
(2)锌的金属性强于铜,则由Zn一Cu一硫酸溶液组成的原电池中锌是负极,失去电子,负极电极反应式为Zn—2e—=Zn2+;铜是正极,溶液中的氢离子放电产生去,即正极反应式为2H++2e-=H2↑,工作一段时间后锌片的质量减少了6.5g,则消耗锌的物质的量是6.5g÷65g/mol=0.1mol,转移0.2mol电子,因此产生氢气是0.1mol,在标准状况下的体积是0.1mol×22.4L/mol=2.24L;原电池中阳离子向正极移动,因此溶液中的H+移向正极。
(3)焓变即反应热=反应物中总键能-生成物中总键能,则生成2mol氨气的反应热=3×436kJ/mol+946kJ/mol-2×3×391kJ/mol=-92kJ/mol,因此H2与N2反应生成0.5 molNH3放出的热量是92kJ/mol×0.5mol/2=23kJ。
(4)①Am+和Bn-它们的核外电子排布相同,故A原子比B原子多一个电子层,故二者的周期数之差为1;
②Am+和Bn-它们的核外电子排布相同,由核电荷数=原子序数=核外电子数可知ZA-m=ZB+n,则ZA-ZB=m+n;③B的族序数为8-n,A的族序数为m,B和A的族序数之差为8-n-m。