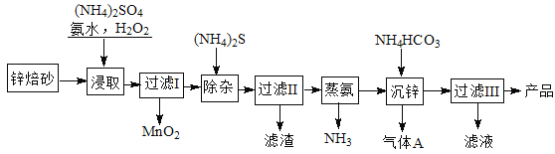
��Ŀ����
����Ŀ����ˮ���Ȼ�������������ǿ�ҵ���ˮ�ԣ���һ����;�ȽϹ㷺���Ρ�
��1��ʵ�����пɽ�FeCl3��Һ �� �����ˡ�ϴ�Ӹ����FeCl3��6H2O���� ���õ���ˮFeCl3��
��2������ʱ��FeCl3��Һ�еμ�NaOH��Һ������ҺpHΪ2.7ʱ��Fe3+��ʼ����������ҺpHΪ4ʱ��c(Fe3+)= mol��L-1����֪��Ksp[Fe(OH)3]= 1.1��10-36����
��3�����ù�ҵFeCl3��ȡ�����IJ���������[Fe2(C2O4)3��5H2O]��ʵ����������ͼ��ʾ��
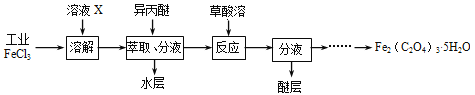
��Ϊ����FeCl3ˮ�⣬��ҺXΪ ��
������������FeCl3�ܱ��������ȡ����ԭ���� ��������ȡ����Һ������ˮ�����Ƿ���Fe3+�ķ����� ��
������Fe2(C2O4)3��5H2O���ñ�ˮϴ�ӣ���Ŀ���� ��
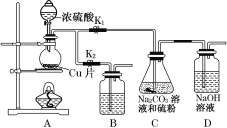
��Ϊ�ⶨ���ò���������Ĵ��ȣ�ʵ���ҳ�ȡa g��Ʒ���������ữ����KMnO4����Һ�ζ����ɵ�H2C2O4��KMnO4����ҺӦ������ͼ��ʾ���� �������ס����ҡ����У�������������ʵ����Fe2(C2O4)3��5H2O����ƫ�͵��� ��
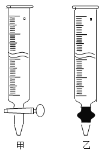
a��ʢ��KMnO4�ĵζ���ˮϴ��δ�ñ�Һ��ϴ
b���ζ��ܵζ�ǰ���첿�������ݣ��ζ�����ʧ
c���ζ�ǰ���Ӷ������ζ����Ӷ���
���𰸡���1��������Ũ��������ȴ���ᾧ������FeCl3��6H2O��HCl�������м�����ˮ
��2��1.1��10-6
��3���٣�Ũ��������FeCl3��������е��ܽ�ȴ�������ˮ�е��ܽ����ȡ����Һ�������еμ�����KSCN��Һ������Һ��죬����Fe3+������������������������ȥ���ʡ����ٲ�����������ܽ���� ���ף� c
��������
���������
��1��ʵ�����пɽ�FeCl3��Һ����Ũ������ȴ�ᾧ������ϴ�ӵõ��Ȼ�������FeCl36H2O����FeCl36H2O
��HCl�������м��ȣ�����������ˮ����ˮ�õ���ˮFeCl3��
��2����ҺpHΪ4ʱ��c(OH-)=10-10������Ksp[Fe(OH)3]=c(Fe3+)c3(OH)����֪c(Fe3+)=![]() =
=
![]() mol/L=1.1��10-6 mol/L��
mol/L=1.1��10-6 mol/L��
��3�����ữFeCl3�������ữ�����������ʣ������������ӵ�ˮ����
����ȡ�����������ڲ�ͬ�ܼ��е��ܽ�Ȳ��������ȡ���ʵ�һ�ַ���������ȡ˵��FeCl3�������
�е��ܽ�ȴ�������ˮ�е��ܽ�ȣ�����Fe3+��KSCN��ҺЧ�������ȡ������Һ�������еμ���
��KSCN��Һ������Һ��죬����Fe3+��
��ϴ���dz�ȥ�����������ʣ���ˮ���¶ȵͣ��������ٳ������ܽ���ʧ��
��KMnO4����Һ����ǿ�����ԣ��ɸ�ʴ�ܣ�����Ӧ������ʽ�ζ����У�a��û����ϴ���¸���
���Ũ�ȵ�����������࣬ʹ�ⶨ���ƫ�ߣ�b�����ݻᵼ�����������Һ���������ƫ����ʹ��
�����ƫ�ߣ�c���ζ�ǰ���Ӷ������ζ����Ӷ��������������Һ���������ƫС��ʹ�ⶨ���
ƫ����

 �������ϵ�д�
�������ϵ�д�