题目内容
15.已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )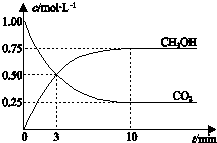
| A. | 升高温度能使$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$ 增大 | |
| B. | 反应达到平衡状态时,CO2的平衡转化率为75% | |
| C. | 3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 | |
| D. | 从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1 |
分析 A.该反应的正反应是放热反应,升高温度平衡逆向移动;
B.反应达到平衡状态时,CO2的平衡转化率=$\frac{(1.00-0.25)mol}{1.00mol}×100%$;
C.3min时,该反应没有达到平衡状态,根据图知,该反应向正反应方向进行,所以正反应速率大于逆反应速率;
D.从反应开始到平衡,υ(CO2)=$\frac{\frac{(1.00-0.25)mol}{1L}}{10min}$=0.075 mol•L-1•min-1,同一可逆反应同一时间段内各物质的反应速率之比等于计量数之比.
解答 解:A.该反应的正反应是放热反应,升高温度平衡逆向移动,甲醇的物质的量浓度减小、二氧化碳物质的量浓度增大,所以升高温度能使$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$ 减小,故A错误;
B.反应达到平衡状态时,CO2的平衡转化率=$\frac{(1.00-0.25)mol}{1.00mol}×100%$=75%,故B正确;
C.3min时,该反应没有达到平衡状态,根据图知,该反应向正反应方向进行,所以正反应速率大于逆反应速率,则CO2的浓度表示的正反应速率与CH3OH的浓度表示的逆反应速率不等,故C错误;
D.从反应开始到平衡,υ(CO2)=$\frac{\frac{(1.00-0.25)mol}{1L}}{10min}$=0.075 mol•L-1•min-1,同一可逆反应同一时间段内各物质的反应速率之比等于计量数之比,所以υ(H2)=3υ(CO2)=3×0.075 mol•L-1•min-1=0.225mol•L-1•min-1,故D错误;
故选B.
点评 本题以图象分析为载体考查化学平衡计算、外界条件对化学平衡移动影响等知识点,注意图中3min时两线相交点不是平衡点,所以正逆反应速率不等,为易错点.

| A. | 1 mol S与足量Fe反应,转移的电子数为3NA个 | |
| B. | 1.5 mol NO2与足量H2O反应,转移的电子数为2NA个 | |
| C. | 常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA个 | |
| D. | 100 ml 0.10mol/L的氨水中,含NH3•H2O 分子0.01NA个 |
| A. | 硅胶常用于作干燥剂 | |
| B. | 氢氟酸可以用来刻蚀玻璃 | |
| C. | 实验室盛装NaOH溶液的试剂瓶用玻璃塞 | |
| D. | 硅酸钠的水溶液俗称水玻璃,可用于制备木材防火剂 |
| A. | 最外层价电子数 | B. | 原子半径 | C. | 元素的非金属性 | D. | 最高化合价 |
| A. | 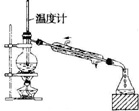 蒸馏石油 | B. | 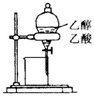 除去乙醇中的乙酸 | ||
| C. | 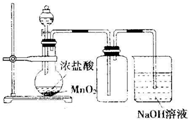 实验室制氯气 | D. | 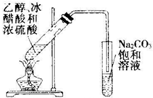 实验室制乙酸乙酯 |
| A. | 油脂在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 | |
| C. | 在水溶液里,乙酸分子中的-CH3可以电离出H+ | |
| D. | 医学上了利用银镜反应来检验患者尿液中葡萄糖含量是否偏高 |
用中和滴定的方法测定NaOH和Na2CO3的混合溶液中NaOH的含 量,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全转变成BaCO3沉淀,然后用标准盐酸滴定(已知几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10)。
量,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全转变成BaCO3沉淀,然后用标准盐酸滴定(已知几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10)。
(1)滴定时应选用  作指示剂;
作指示剂;
(2)判断到达滴定终点的实验现象是  。
。
(3)下列操作会导致烧碱样品中NaOH含量测定值偏高的是
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴 定前有气泡,滴定后气泡消失
定前有气泡,滴定后气泡消失
D.滴定前平视读数,滴定结束俯视读数
(4)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加 入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol·
入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol· L-1的盐酸标准液进行滴定,相关数据记录如下:
L-1的盐酸标准液进行滴定,相关数据记录如下:
实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
初读数 | 末读数 | ||
1 | 20.00 | 0.80 | 21.00 |
2 | 20.00 | 1.00 | 20.80 |
3 | 20.00 | 0.20 | 22.80 |
依据表中数据,计算出烧碱样品中含NaOH的质量分数为 。(小数点后保留两位数字)

已知几种氢氧化物开始沉淀和完全沉淀的pH如下表所示
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
(1)用2mol/L H2SO4溶液溶解草酸亚铁样品而不用蒸馏水直接溶解的原因是防止Fe2+水解加热至70℃左右,立即用KMnO4溶液滴定至终点.发生反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O和MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O
(2)保温放置30min的目的是使反应更完全
(3)证明反应Ⅰ完全的实验操作或现象为溶液呈紫红色,取少许紫红色溶液于试管中,滴加KSCN溶液,溶液颜色无明显变化
(4)已知常温下Fe(OH)3的Ksp=1.1×10-36,废液中c(Fe3+)=1.1×10-6mol•L-1.
(5)灼烧充分的标志是连续两次灼烧、冷却、称量所得质量差不超过0.1g
(6)样品中FeC2O4的含量为72%.
 2C(g)+D(s),1molA和3molB在2L密闭容器中进行上述反应,若2min后,测得C的浓度为0.2mol/L,则下列说法正确的是( )
2C(g)+D(s),1molA和3molB在2L密闭容器中进行上述反应,若2min后,测得C的浓度为0.2mol/L,则下列说法正确的是( )