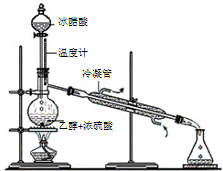
题目内容
6.下列说法错误的是( )| A. | 硅胶常用于作干燥剂 | |
| B. | 氢氟酸可以用来刻蚀玻璃 | |
| C. | 实验室盛装NaOH溶液的试剂瓶用玻璃塞 | |
| D. | 硅酸钠的水溶液俗称水玻璃,可用于制备木材防火剂 |
分析 A.硅胶具有高活性吸附材料,可用作干燥剂;
B.氢氟酸能够与玻璃中的二氧化硅反应;
C.二氧化硅与氢氧化钠溶液反应生成具有粘性的硅酸钠;
D.硅酸钠不燃烧,可用于制备木材防火剂.
解答 解:A.硅胶具有高活性吸附材料,可用作干燥剂,故A正确;
B.氢氟酸能够与玻璃中的二氧化硅反应,所以能够腐蚀玻璃,可以用来雕刻玻璃,故B正确;
C.二氧化硅与氢氧化钠溶液反应生成具有粘性的硅酸钠,盛装NaOH溶液的试剂瓶用玻璃塞,瓶塞与瓶容易粘到一块,故C错误;
D.硅酸钠的水溶液俗称水玻璃,不易燃烧,可以用于制备防火木材,故D正确;
故选:C.
点评 本题考查二氧化硅及硅酸盐,明确二氧化硅的性质是解答本题的关键,注意硅及其化合物的用途,题目难度不大.

练习册系列答案
相关题目
16.25℃时,物质的量浓度均为0.01mol•L-1 的HA和BOH溶液,pH分别为3和12,将物质的量浓度相等两溶液等体积混合后,所得溶液的pH( )
| A. | 可能等于7 | B. | 一定<7 | C. | 一定>7 | D. | 无法判断 |
17.相同温度,相同物质的量浓度的四种溶液:①CH3COONa ②NaHSO4 ③NaCl ④C6H5-ONa ⑤NaHCO3 ⑥Na2CO3,按pH由大到小的顺序排列,正确的是( )
| A. | ⑥>⑤>④>①>③>② | B. | ⑥>④>⑤>①>③>② | C. | ⑥>④>⑤>①>②>③ | D. | ⑥>⑤>④>①>③>② |
14.与NH4+互为等电子体的微粒是( )
| A. | H3O+ | B. | OH- | C. | NH3 | D. | CH4 |
15.已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )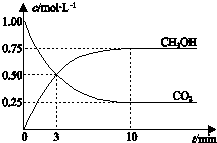

| A. | 升高温度能使$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$ 增大 | |
| B. | 反应达到平衡状态时,CO2的平衡转化率为75% | |
| C. | 3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 | |
| D. | 从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1 |
已知某化学反应的平衡常数表达式为K=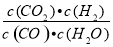 ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是( )
A.该反应的化学方程式是CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.若在1L的密闭容器中通入CO2和H2各1mol,5min后温度升高到830℃,此时测得CO2为0.4mol时,该反应达到平衡状态
D.若平衡浓度符合下列关系式: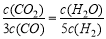 ,则此时的温度为1000℃
,则此时的温度为1000℃
 ,该分子中官能团的名称为羧基、羟基,可以和醇类物质发生酯化(或取代)反应,还可以发生分子内脱水生成马来酸,马来酸能使溴水褪色,则马来酸的结构简式为HOOC-CH=CH-COOH.
,该分子中官能团的名称为羧基、羟基,可以和醇类物质发生酯化(或取代)反应,还可以发生分子内脱水生成马来酸,马来酸能使溴水褪色,则马来酸的结构简式为HOOC-CH=CH-COOH.