题目内容
5.设阿伏加德罗常数的数值为NA,下列说法正确的是( )| A. | 1 mol S与足量Fe反应,转移的电子数为3NA个 | |
| B. | 1.5 mol NO2与足量H2O反应,转移的电子数为2NA个 | |
| C. | 常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA个 | |
| D. | 100 ml 0.10mol/L的氨水中,含NH3•H2O 分子0.01NA个 |
分析 A、氯气和铁反应生成氯化铁,电子转移按照全部反应的氯气计算;
B、二氧化氮和水的反应中,二氧化氮既是氧化剂又是还原剂;
C、NO2和N2O4具有相同的最简式NO2;
D、n=CV,一水合氨是弱电解质存在电离平衡.
解答 解:A、氯气和铁反应生成氯化铁,电子转移按照全部反应的氯气计算,转移电子2NA,故A错误;
B、二氧化氮和水的反应3NO2+H2O═2HNO3+NO,1.5molNO2与足量H2O反应,转移的电子数以生成的NO计算为0.5×2NA=NA,故B错误;
C、NO2和N2O4具有相同的最简式NO2,46g的NO2和N2O4混合气体含有的原子数为$\frac{46g}{46g/mol}$×3NA=3NA,故C正确;
D、100 ml 0.10mol/L的氨水中,溶质物质的量=0.1L×0.1mol/L=0.01mol,一水合氨是弱电解质存在电离平衡,含NH3•H2O 分子小于0.01NA个,故D错误;
故选C.
点评 本题考查学生有关阿伏伽德罗常熟的有关计算知识,主要是气体摩尔体积条件分析,氧化还原反应电子转移计算,物质的量和微粒数的计算分析,可以根据所学知识来回答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.天然气是一种多组分的化石燃料.其主要成分是( )
| A. | 甲烷 | B. | 氮气 | C. | 氢气 | D. | 氧气 |
16.25℃时,物质的量浓度均为0.01mol•L-1 的HA和BOH溶液,pH分别为3和12,将物质的量浓度相等两溶液等体积混合后,所得溶液的pH( )
| A. | 可能等于7 | B. | 一定<7 | C. | 一定>7 | D. | 无法判断 |
20.下列实验所选装置不合适的是( )

| A. | 分离水和泥沙选① | B. | 从盐水中获得食盐选② | ||
| C. | 分离酒精和水选③ | D. | 由自来水制取纯净水选④ |
10.CO2的资源化利用是解决温室效应的重要途径.以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰胺的反应: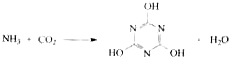 下列有关三聚氰胺的说法正确的是( )
下列有关三聚氰胺的说法正确的是( )
 下列有关三聚氰胺的说法正确的是( )
下列有关三聚氰胺的说法正确的是( )| A. | 分子式为C3H6N3O3 | B. | 分子中既含极性键,又含非极性键 | ||
| C. | 属于共价化合物 | D. | 生成该物质的上述反应为中和反应 |
17.相同温度,相同物质的量浓度的四种溶液:①CH3COONa ②NaHSO4 ③NaCl ④C6H5-ONa ⑤NaHCO3 ⑥Na2CO3,按pH由大到小的顺序排列,正确的是( )
| A. | ⑥>⑤>④>①>③>② | B. | ⑥>④>⑤>①>③>② | C. | ⑥>④>⑤>①>②>③ | D. | ⑥>⑤>④>①>③>② |
14.与NH4+互为等电子体的微粒是( )
| A. | H3O+ | B. | OH- | C. | NH3 | D. | CH4 |
15.已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )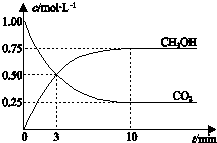

| A. | 升高温度能使$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$ 增大 | |
| B. | 反应达到平衡状态时,CO2的平衡转化率为75% | |
| C. | 3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 | |
| D. | 从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1 |
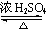 CH3COOCH2CH=CH2+H218O,酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式
CH3COOCH2CH=CH2+H218O,酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式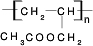 .
.