题目内容
15.下列由短周期元素形成的离子化合物中,阳离子半径与阴离子半径之比最大的是( )| A. | LiCl | B. | Na2O | C. | NaF | D. | MgS |
分析 阳离子半径和阴离子半径之比最大,就是找阳离子半径最大的,阴离子半径最小的,离子电子层越多,离子半径越大,电子层结构相同的离子,核电荷数越大离子半径越小.
解答 解:离子电子层越多,离子半径越大,电子层结构相同的离子,核电荷数越大离子半径越小,则:
金属离子半径:Na+>Mg2+>Li+,阴离子半径:S2->Cl->O2->F-,
要求阳离子半径和阴离子半径之比最大的,就阳离子半径最大的,阴离子半径最小的,则NaF符合要求,
故选C.
点评 本题考查微粒半径比较,明确规律即可解答,注意对基础知识的理解掌握,知道离子半径大小与电子层数有关.

练习册系列答案
相关题目
8.下列离子方程式正确的是( )
| A. | 明矾溶液中滴加Ba(OH)2溶液至SO42-完全沉淀:Al3++Ba2++SO42-+3OH-═BaSO4↓+Al(OH)3↓ | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2 NO↑+4H2O | |
| D. | MgSO4溶液与Ba(OH)2溶液混合:SO42-+Ba2+═BaSO4↓ |
6.对于第三周期元素的有关叙述错误的是( )
| A. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | |
| B. | 电负性:Si<P<S | |
| C. | 第一电离能:Na<Mg<Al | |
| D. | Cl-核外电子排布式:1s22s22p63s23p6 |
3.我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学的角度来说,“往伤口上撒盐”的做法并无不妥,甚至可以说并不是害人而是救人.那么,这种做法的化学原理是( )
| A. | 胶体的电泳 | B. | 血液的氧化还原反应 | ||
| C. | 血液中发生复分解反应 | D. | 胶体的聚沉 |
10.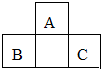 短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
 短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )| A. | Be、Na、Al | B. | C、Al、P | C. | B、Mg、Si | D. | O、P、Cl |
20.下列说法正确的是( )
| A. | 同周期主族元素简单离子的半径随核电荷数的增加而减小 | |
| B. | 同主族元素含氧酸的酸性随核电荷数的增加而降低 | |
| C. | 质子数相同的微粒化学性质也相同 | |
| D. | ${\;}_{92}^{235}$U与${\;}_{92}^{238}$U具有相同的核外电子排布 |
7.下列有关阿伏伽德罗常数(NA)的说法错误的是( )
| A. | 32克O2所含的原子数目为2NA | |
| B. | 1mol Cl2与1mol H2反应转移电子数目为2NA | |
| C. | 标准状况下,22.4L水中含有NA个水分子 | |
| D. | 20g重水所含的电子数目为10NA |
9.由短周期前10号元素组成的物质T和X,有如图所示的转化.X不稳定,易分解.为使得下列转化能够成功进行,方框内不可能加入的反应试剂是( )
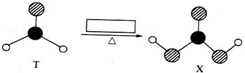

| A. | 新制Cu(OH)2悬浊液 | B. | 溴水 | C. | 酸性KMnO4溶液 | D. | NaOH溶液 |

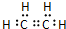 ,分子中含有的共价键类型有非极性键、极性键(填极性键或非极性键). C中含官能团名称羟基;
,分子中含有的共价键类型有非极性键、极性键(填极性键或非极性键). C中含官能团名称羟基; ,反应类型:加聚反应.⑤CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,反应类型:加成反应.
,反应类型:加聚反应.⑤CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,反应类型:加成反应.