题目内容
9.由短周期前10号元素组成的物质T和X,有如图所示的转化.X不稳定,易分解.为使得下列转化能够成功进行,方框内不可能加入的反应试剂是( )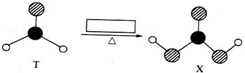
| A. | 新制Cu(OH)2悬浊液 | B. | 溴水 | C. | 酸性KMnO4溶液 | D. | NaOH溶液 |
分析 由球棍模型可知,T为HCHO,X不稳定,易分解,则X为H2CO3,则方框内物质为氧化剂,以此来解答.
解答 解:由球棍模型可知,T为HCHO,X不稳定,易分解,则X为H2CO3,则方框内物质为氧化剂,
A.新制Cu(OH)2悬浊液为弱氧化剂,新制Cu(OH)2悬浊液能氧化HCHO生成碳酸,故A错误;
B.溴水中含有HBrO,HBrO能氧化HCHO生成碳酸,故B错误;
C.KMnO4为强氧化剂,酸性KMnO4溶液能氧化HCHO生成碳酸,故C错误;
D.NaOH溶液与HCHO不反应,即方框内物质一定不为NaOH溶液,故D正确;
故选:D.
点评 本题考查有机物的推断,明确HCHO的性质是解答本题的关键,题目难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
17.13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,瑞士科学家库尔特、维特里希等人为此获得2002年诺贝尔化学奖.下列有关13C、15N的叙述正确的是( )
| A. | 15N与14N互为同位素 | B. | 13C与C60互为同素异形体 | ||
| C. | 13C、15N具有相同的中子数 | D. | 15N的核外电子数与中子数相同 |
15.下列由短周期元素形成的离子化合物中,阳离子半径与阴离子半径之比最大的是( )
| A. | LiCl | B. | Na2O | C. | NaF | D. | MgS |
12.下列酸性氧化物和水化物的关系不对应的是( )
| A. | SiO2 H4SiO4 | B. | Cl2O HClO4 | C. | Mn2O7 HMnO4 | D. | N2O5 HNO3 |
14.已知由石墨制备金刚石的反应为:C(石墨)一定条件_C(金刚石);△H>0,则下列两个反应中:C(石墨)+O2(g)═CO2(g);△H=a kJ/mol,C(金刚石)+O2(g)═CO2(g);△H=b kJ/mol,a与b的关系为( )
| A. | a>b | B. | a<b | C. | a=b | D. | 无法确定 |
1.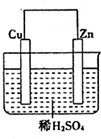 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:在卡片上,描述合理的是( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:在卡片上,描述合理的是( )
卡片:NO.28Date:2007.4.8
实验后的记录:
①Zn为阳极,Cu为阴极②H+向负极移动
③电子流动方向Zn→Cu④Cu极有H2产生
⑤若有1mol电子流过导线,则产生H2为0.5mol.
⑥正极的电极反应式:Zn-2e-═Zn2+.
 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:在卡片上,描述合理的是( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:在卡片上,描述合理的是( )卡片:NO.28Date:2007.4.8
实验后的记录:
①Zn为阳极,Cu为阴极②H+向负极移动
③电子流动方向Zn→Cu④Cu极有H2产生
⑤若有1mol电子流过导线,则产生H2为0.5mol.
⑥正极的电极反应式:Zn-2e-═Zn2+.
| A. | ①②③ | B. | ③④⑤ | C. | ④⑤⑥ | D. | ②③④ |
18. 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液;
a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD.
A.c(H+) B.c(H+)c(CH3COOH) C.c(H+)•c(OH-) D.c(OH−)c(H+) E.c(H+)•c(CH3COO−)c(CH3COOH)
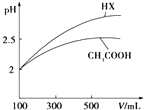
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则同温度时HX的电离平衡常数_大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是稀释相同倍数,一元酸HX的pH变化比CH3COOH的大,故HX酸性较强,电离平衡常数较大.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(填精确值).
(5)标准状况下,将1.12L CO2通入100mL 0.75mol•L-1的NaOH溶液中,则溶液中离子的浓度由大到小的顺序c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液;
a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD.
A.c(H+) B.c(H+)c(CH3COOH) C.c(H+)•c(OH-) D.c(OH−)c(H+) E.c(H+)•c(CH3COO−)c(CH3COOH)
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则同温度时HX的电离平衡常数_大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是稀释相同倍数,一元酸HX的pH变化比CH3COOH的大,故HX酸性较强,电离平衡常数较大.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(填精确值).
(5)标准状况下,将1.12L CO2通入100mL 0.75mol•L-1的NaOH溶液中,则溶液中离子的浓度由大到小的顺序c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
 .试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.
.试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.