题目内容
7.下列有关阿伏伽德罗常数(NA)的说法错误的是( )| A. | 32克O2所含的原子数目为2NA | |
| B. | 1mol Cl2与1mol H2反应转移电子数目为2NA | |
| C. | 标准状况下,22.4L水中含有NA个水分子 | |
| D. | 20g重水所含的电子数目为10NA |
分析 A.氧气为双原子分子,1mol氧气含有2mol氧原子;
B、氯气和氢气反应生成氯化氢,电子转移依据反应的氯气或氢气计算;
C、水在标准状况下不是气体;
D、物质的量=$\frac{m}{M}$,D2O中含有电子数为10.
解答 解:A.32g氧气的物质的量是1mol,所以含有2mol氧原子,所含的原子数目为2NA,故A正确;
B、氯气和氢气反应生成氯化氢,电子转移依据反应的氯气或氢气计算,1mol Cl2与1mol H2反应转移电子数目为2NA,故B正确;
C、标准状况下水不是气体,22.4L水物质的量不是1mol,所以水分子数不是NA个,故C错误;
D、物质的量=$\frac{m}{M}$=$\frac{20g}{20g/mol}$=1mol,D2O中含有电子数为10NA,故D正确;
故选C.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确分子、原子、原子核内质子中子及核外电子的构成关系,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
20.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 3.6g重水中含有的中子数为2NA | |
| B. | 16.0g的过氧(根)离子中含有的电子数为9NA | |
| C. | 100mL 3.0mol/L的盐酸与5.6g铁屑完全反应转移的电子数为0.3NA | |
| D. | 含2mol H2SO4的浓硫酸与足量金属铜完全反应,产生SO2分子数为NA |
18.下列对化学用语的理解正确的是( )
| A. | Na218O中氧离子的结构示意图: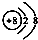 | |
| B. | 比例模型 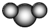 ,表示二氧化碳或水分子 ,表示二氧化碳或水分子 | |
| C. | 碳正离子 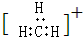 中质子数与电子数之比值为3:2 中质子数与电子数之比值为3:2 | |
| D. | TNT 结构简式: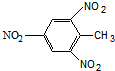 |
15.下列由短周期元素形成的离子化合物中,阳离子半径与阴离子半径之比最大的是( )
| A. | LiCl | B. | Na2O | C. | NaF | D. | MgS |
12.下列酸性氧化物和水化物的关系不对应的是( )
| A. | SiO2 H4SiO4 | B. | Cl2O HClO4 | C. | Mn2O7 HMnO4 | D. | N2O5 HNO3 |
1.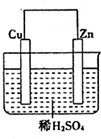 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:在卡片上,描述合理的是( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:在卡片上,描述合理的是( )
卡片:NO.28Date:2007.4.8
实验后的记录:
①Zn为阳极,Cu为阴极②H+向负极移动
③电子流动方向Zn→Cu④Cu极有H2产生
⑤若有1mol电子流过导线,则产生H2为0.5mol.
⑥正极的电极反应式:Zn-2e-═Zn2+.
 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:在卡片上,描述合理的是( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:在卡片上,描述合理的是( )卡片:NO.28Date:2007.4.8
实验后的记录:
①Zn为阳极,Cu为阴极②H+向负极移动
③电子流动方向Zn→Cu④Cu极有H2产生
⑤若有1mol电子流过导线,则产生H2为0.5mol.
⑥正极的电极反应式:Zn-2e-═Zn2+.
| A. | ①②③ | B. | ③④⑤ | C. | ④⑤⑥ | D. | ②③④ |
2.在2L容积不变的容器中,发生N2+3H2?2NH3的反应.现通入4mol H2和4mol N2,10s内用H2表示的反应速率为0.12mol/(L•s),则10s后容器中N2的物质的量是( )
| A. | 1.6 mol | B. | 2.8 mol | C. | 3.2 mol | D. | 3.6 mol |
 .试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.
.试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.